业务咨询

1、实验原理
细胞衰老(cellular senescence)是细胞在应激(如端粒缩短、DNA损伤、氧化应激等)下进入的一种不可逆增殖停滞状态,但其代谢活性仍部分保留。衰老细胞会分泌大量炎症因子、趋化因子、基质重塑酶等,形成致病性衰老相关分泌表型(SASP),是衰老影响周围组织的核心机制,该表型可驱动继发性衰老并破坏组织稳态,导致组织修复和再生丧失。细胞衰老标志物是指在细胞衰老过程中出现的特征性变化,这些标志物可以用于检测和研究细胞衰老。包括:1)原发性标志:基因组不稳定性、端粒缩短、表观遗传改变、蛋白质稳态失衡;2)拮抗性标志:自噬功能障碍、营养感应失调、线粒体功能障碍、细胞衰老、干细胞耗竭;3)整合型标志:细胞间通讯改变、慢性炎症、菌群失调、细胞外基质变化和心理社会隔离。这些标志相互关联,共同推动了衰老的进程。
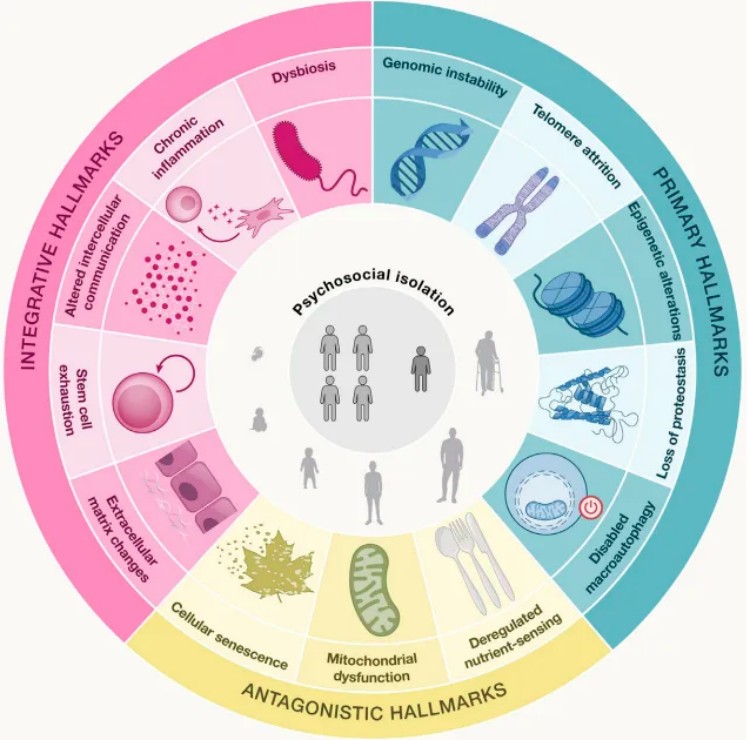
图1.衰老的14个特征及其在原发性、拮抗剂和综合性衰老过程中的作用的示意性概述
1)基因组不稳定性:DNA损伤增加且修复能力下降,导致基因突变和染色体异常,进而引发细胞功能障碍和疾病,标志物γ-H2AX;
2)端粒磨损:端粒会随着细胞分裂逐渐缩短,当端粒缩短到一定程度时,细胞就会失去分裂能力,标志物端粒长度、端粒相关蛋白(如TRF2);
3)表观遗传改变:表观遗传改变是指基因表达调控机制发生变化,影响基因的表达和功能,标志物DNA甲基化(DNMT1)、组蛋白修饰;
4)蛋白质稳态丧失:蛋白质折叠、修饰和降解等过程失调,导致蛋白质聚集和功能异常,标志物蛋白质聚集(如泛素化蛋白聚集)、分子伴侣蛋白(如HSP70);
5)细胞自噬失能:细胞自噬是清除受损细胞器和蛋白质的重要机制,其功能下降会导致细胞内废物积累,标志物自噬相关蛋白(如LC3-II/LC3-I比值);
6)营养感应失调:细胞对营养物质的感应和代谢调节能力下降,影响能量代谢和细胞功能,标志物胰岛素/IGF-1信号通路相关蛋白(如AKT、mTOR)、AMPK活性;
7)线粒体功能障碍:线粒体的能量代谢功能下降,导致能量代谢异常和细胞损伤,标志物线粒体膜电位(如JC-1荧光探针)、线粒体DNA损伤;
8)细胞衰老:细胞进入不可逆的生长停滞状态,但不会死亡,还会释放炎症因子,标志物β-半乳糖苷酶(SA-β-Gal)活性、p16INK4a和p21CIP1蛋白表达;
9)干细胞耗竭:干细胞数量减少、功能下降,导致组织和器官的修复能力减弱,标志物干细胞标志物(如CD34、CD133)、干细胞数量(通过流式细胞术检测);
10)细胞间通讯改变:细胞间的信号传导和相互作用发生改变,影响组织和器官的功能;标志物细胞因子(如IL-6、TNF-α)、细胞外囊泡(如外泌体);
11)慢性炎症:低度慢性炎症状态持续存在,导致组织损伤和疾病发生,标志物白细胞介素-6(IL-6);
12)菌群失调:肠道微生物群落失衡,影响免疫系统和代谢功能,标志物肠道菌群组成(通过16S rRNA测序)、短链脂肪酸(如乙酸、丙酸);
13)细胞外基质变化:细胞外基质的成分和结构发生改变,影响细胞的微环境和功能,标志物胶原蛋白和弹性纤维含量、基质金属蛋白酶(MMPs)活性;
14)心理-社会隔离:社会交往减少、心理压力增加等心理社会因素对衰老产生影响,标志物心理压力标志物(如皮质醇水平)、社会支持评估问卷。
本实验拟利用人永生化角质形成细胞/人真皮成纤维细胞等构建实验模型,通过检测相关衰老标志物的表达,多维度评价样品是否具有抗衰老作用。
2、检测项目
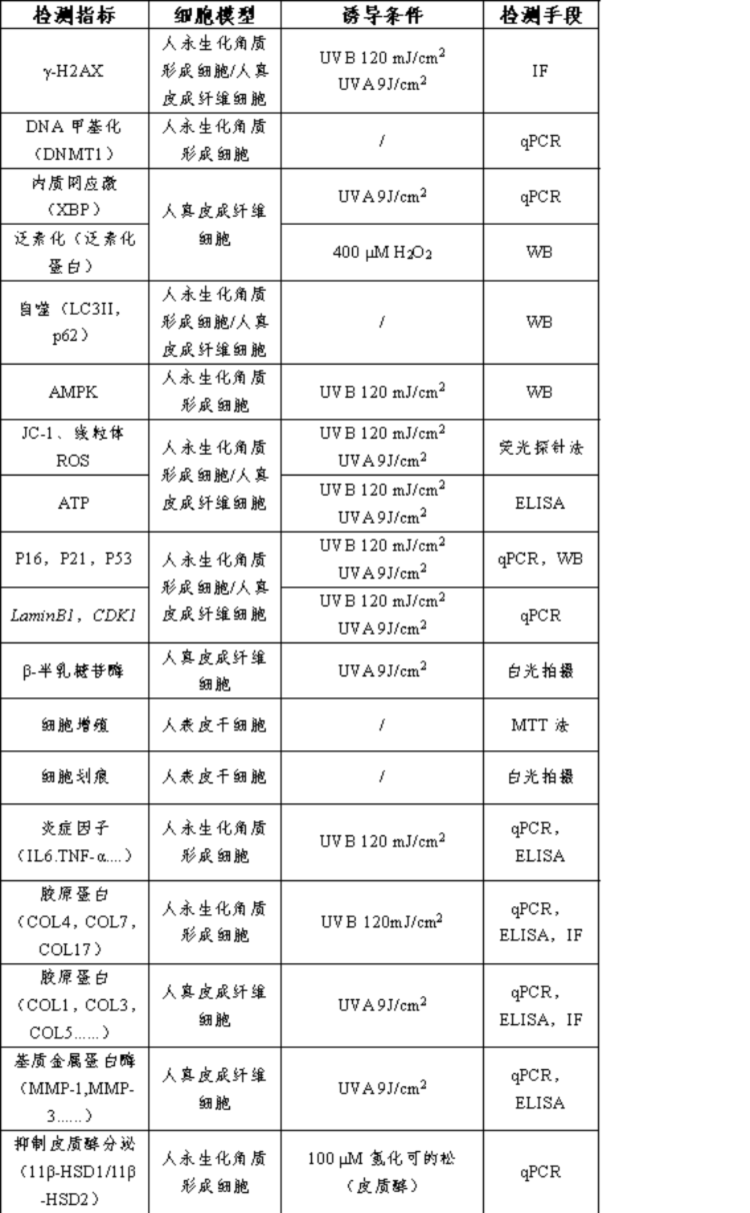
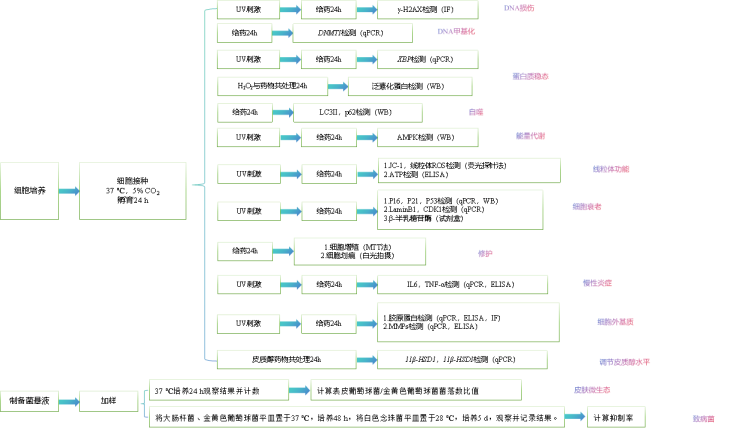
3.检测流程
4.部分结果展示
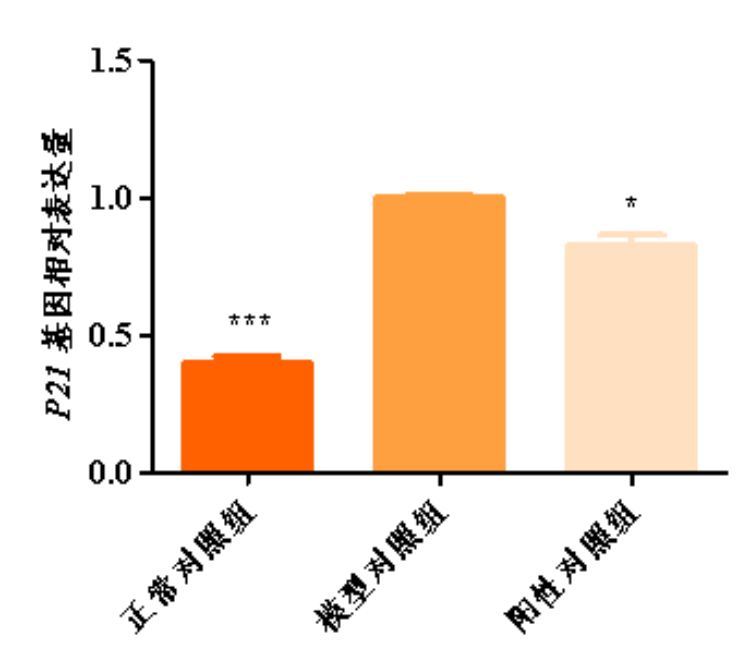
图1.P21基因相对表达量柱形图
与模型对照组比,*p<0.05,***p<0.001
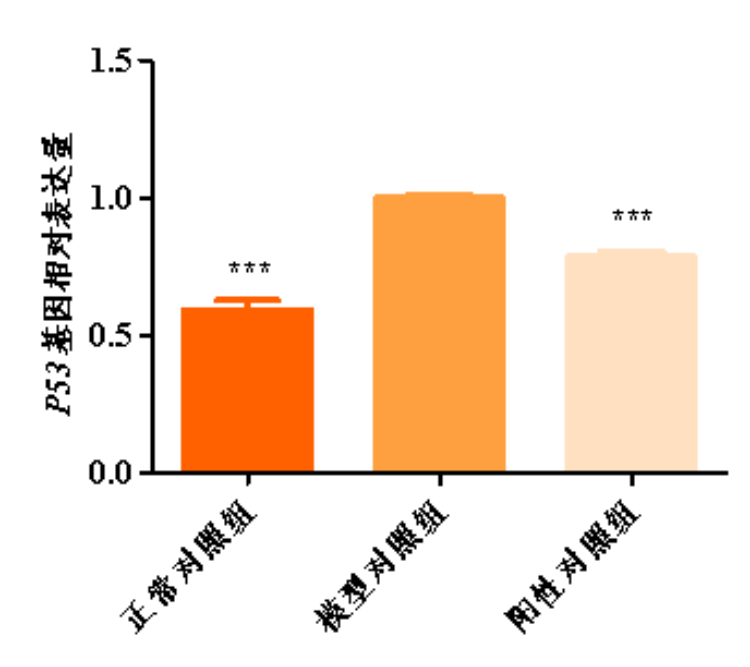
图2.P53基因相对表达量柱形图
与模型对照组比,*p<0.05,***p<0.001
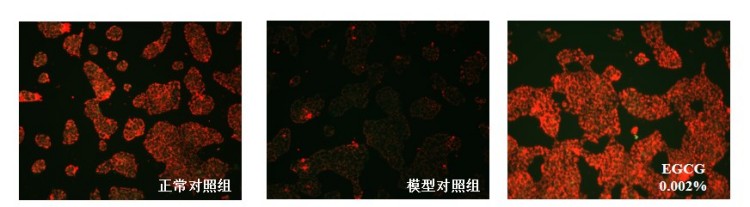
图3.线粒体膜电位红色/绿色荧光典型图
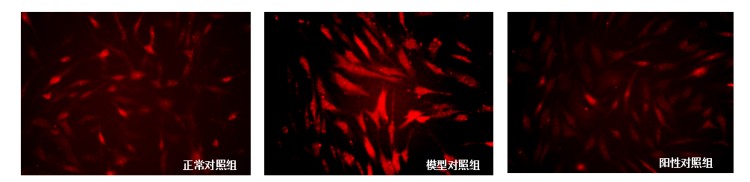
图4.线粒体ROS典型图
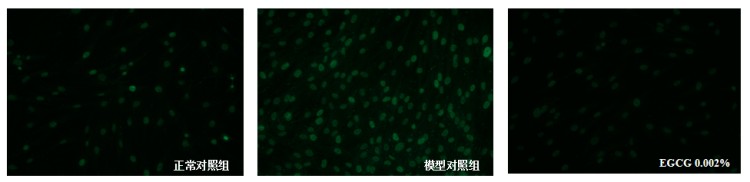
图5.γ-H2AX典型图
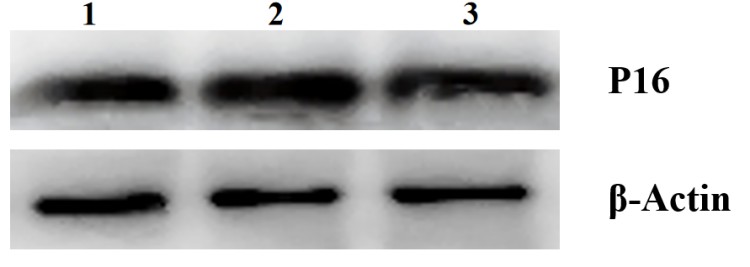
图6.P16蛋白表达典型图
5.结果描述
根据测试结果,与正常对照组比,模型对照组的JC-1红色荧光/绿色荧光比值显著下调,线粒体ROS平均荧光强度显著上调,γ-H2AX平均荧光强度显著上调,p16蛋白表达显著上调,P53和P21基因相对表达量显著上调,说明本次刺激有效;
与模型对照组比,阳性对照组的JC-1红色荧光/绿色荧光比值显著上调,线粒体ROS平均荧光强度显著下调,γ-H2AX平均荧光强度显著下调,p16蛋白表达显著下调,P53和P21基因相对表达量显著下调,说明本实验有效且可靠。
6.参考文献
[1] Zhang L, Pitcher LE, Yousefzadeh MJ, Niedernhofer LJ, Robbins PD, Zhu Y. Cellular senescence: a key therapeutic target in aging and diseases. J Clin Invest. 2022 Aug 1;132(15):e158450.
[2] Gao H, Nepovimova E, Heger Z, Valko M, Wu Q, Kuca K, Adam V. Role of hypoxia in cellular senescence. Pharmacol Res. 2023 Aug;194:106841.
[3] Wang AS, Dreesen O. Biomarkers of Cellular Senescence and Skin Aging. Front Genet. 2018 Aug 23;9:247.
[4] Pandey KB, Rizvi SI. Markers of oxidative stress in erythrocytes and plasma during aging in humans. Oxid Med Cell Longev. 2010 Jan-Feb;3(1):2-12.
[5] 牛利刚,周瑜辉,周灿,等.线粒体氧化磷酸化抑制剂对紫杉醇耐药的三阴性乳腺癌细胞衰老的影响[J/OL].中国中西医结合外科杂志,1-5[2025-07-28].
[6] Yang H, Almadani N, Thompson EF, Tessier-Cloutier B, Chen J, Ho J, Senz J, McConechy MK, Chow C, Ta M, Cheng A, Karnezis A, Huvila J, McAlpine JN, Gilks B, Jamieson A, Hoang LN. Classification of Vulvar Squamous Cell Carcinoma and Precursor Lesions by p16 and p53 Immunohistochemistry: Considerations, Caveats, and an Algorithmic Approach. Mod Pathol. 2023 Jun;36(6):100145.
[7] Cai D, Ma X, Guo H, Zhang H, Bian A, Yu H, Cheng W. Prognostic value of p16, p53, and pcna in sarcoma and an evaluation of immune infiltration. J Orthop Surg Res. 2022 Jun 10;17(1):305.
[8] Bao H, Cao J, Chen M et al. Biomarkers of aging. Sci China Life Sci. 2023 May;66(5):893-1066.
[9] Moqri M, Herzog C, Poganik JR et al. Biomarkers of aging for the identification and evaluation of longevity interventions. Cell. 2023 Aug 31;186(18):3758-3775.
[10] Kroemer G, Maier AB, Cuervo AM, Gladyshev VN, Ferrucci L, Gorbunova V, Kennedy BK, Rando TA, Seluanov A, Sierra F, Verdin E, López-Otín C. From geroscience to precision geromedicine: Understanding and managing aging. Cell. 2025 Apr 17;188(8):2043-2062.
严正声明:以上内容所涉及的核心知识产权归杭州环特生物科技股份有限公司所有。任意第三方机构或个人在未经授权的前提下抄袭、剽窃、恶意传播均属侵害我司正当权益的行为,我司不排除诉诸一切法律手段维护自身合法权益。