业务咨询

【实验原理】
目前的研究表明皮肤衰老原因有:β-半乳糖苷酶活性增高(在衰老的细胞中活性升高,是衰老细胞最常用的标志物之一)、活性氧积聚、胶原蛋白与弹性蛋白流失、基质金属酶上调、MAPK和cAMP途径激活等等。
皮肤皱纹的出现与胶原蛋白的正常合成和表达密切相关。斑马鱼具有与人高度保守的调控胶原蛋白的相关基因。通过检测斑马鱼胶原蛋白基因RNA的相对表达量可以反映护肤产品的抗皱功效。弹性蛋白与胶原蛋白共同存在与胞外基质对于皮肤弹性的维系起着重要作用,是皮肤松弛、下垂等老化现象的主要原因。斑马鱼具有与人高度保守的调控弹性蛋白的基因,通过检测斑马鱼弹性蛋白基因RNA的相对表达量可以反映护肤产品的紧致功效。
活性氧(ROS)是含氧的化学反应性化学物质,其在细胞信号传导和体内平衡中具有重要作用。然而在紫外线暴露期间,ROS水平会急剧增加。这可能会对细胞结构造成严重损害,这被称为氧化应激。当自由基产生量大于机体清除能力时就发生氧化应激反应。氧化应激时超氧化物歧化酶( Superoxide dismutase,SOD)活性降低,产生过多的脂质过氧化产物丙二醛( Malondialdehyde,MDA),谷胱甘肽过氧化物酶( Glutathione peroxidase,GSH-Px)是体内重要过氧化物分解酶,能使过氧化物MDA还原,保护细胞免受氧化损伤。因此SOD、MDA、GSH-PX作为判断氧化应激程度的重要指标。
衰老与端粒酶活性相关。端粒有重要的生物学功能,随着年龄的增长,端粒DNA在体细胞分裂过程中自然缩短,当端粒长度变得非常短时,端粒功能受损,导致基因组不稳定、细胞衰老和凋亡。体细胞端粒会随着年龄的增长而逐渐缩短,此时端粒酶会起到延缓端粒缩短的作用,端粒酶活性降低则端粒缩短。可以通过检测端粒酶活性是否增强来判断供试品的抗衰老功效。
衰老与代谢缓慢相关,皮肤微循环可以反映代谢的快慢。可以利用血流分析仪检测受试斑马鱼的血流速度,评价改善微循环功效。
【实验方法】
将受测试斑马鱼分成若干组,含正常对照组和供试品组。其中正常对照组未经任何处理,供试品组添加受试化妆品。加入化妆品24h后,对每组斑马鱼进行收样,使用试剂盒提取RNA,使用q-PCR检测目的基因的转录水平,通过斑马鱼皮肤胶原蛋白基因和弹性蛋白基因相对表达量评价化妆品增加皮肤弹性作用。(指标1、2)
将受测试斑马鱼分成若干组,含正常对照组、模型对照组和供试品组。其中正常对照组未经任何处理,模型对照组和供试品组都加入等量的甲萘醌。供试品组在加入甲萘醌的同时加入一定浓度的化妆品。使用化妆品24 h后,对斑马鱼整体进行特异性荧光染色,观察斑马鱼卵黄囊活性氧自由基产生情况。(指标3)
将受测试斑马鱼分成若干组,含正常对照组、模型对照组和供试品组。其中正常对照组未经任何处理,模型对照组和供试品组都加入等量的过氧化氢。供试品组在加入过氧化氢的同时加入一定浓度的化妆品。处理6 天后,将斑马鱼用4%多聚甲醛固定过夜,用β-半乳糖苷酶染色试剂盒进行染色。染色结束后,分析统计斑马鱼整体β-半乳糖苷酶染色强度,以β-半乳糖苷酶染色强度的统计学分析结果评价供试品对衰老斑马鱼β-半乳糖苷酶活性的抑制作用;将斑马鱼匀浆取上清,用端粒酶活性检测试剂盒检测各实验组端粒酶活性是否增强;用SOD ELISA试剂盒测定各实验组SOD含量是否增加;用GSH ELISA试剂盒测定各实验组GSH含量是否增加。(指标4、5、6、7)。
将斑马鱼分成两组,分别是正常对照组和供试品组。正常对照组不做处理,供试品组添加一定浓度的受试化妆品,孵育24h小时后,通过血流分析仪分析观察各组斑马鱼的血流速度,以血流速度的增加量评价受试化妆品改善微循环功效。(指标8)
【评价指标】
1、Ⅰ型胶原蛋白基因相对表达量
2、弹性蛋白基因相对表达量
3、ROS清除作用
4、β-半乳糖苷酶活性抑制作用
5、端粒酶活性
6、SOD含量
7、GSH含量
8、改善微循环-血流速度
【结果展示】
(*展示图片仅供参考,实际实验组别依据合同而定)
1、胶原or弹性蛋白基因相对表达量:提供柱状图
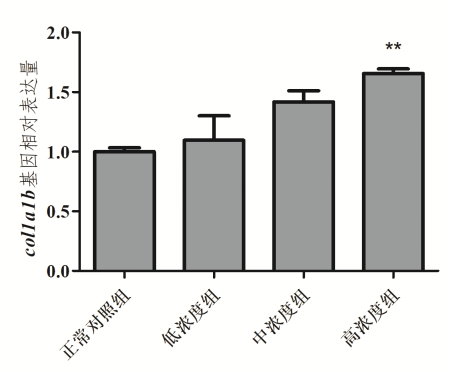
图1. 斑马鱼体内col1a1b基因相对表达量
2、ROS荧光强度
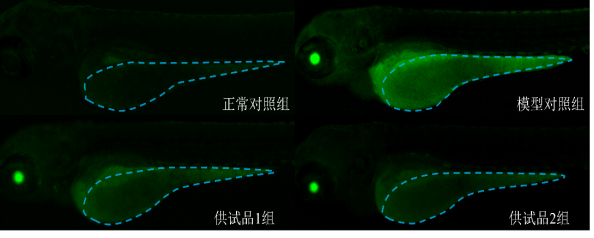
图2. 斑马鱼卵黄囊荧光表型图
3、β-半乳糖苷酶活性、端粒酶活性、SOD含量、GSH含量(柱形图,略)
4、改善微循环-血流速度(柱状图+视频)
【评价结论】
本实验供试品组Ⅰ型胶原蛋白基因,弹性蛋白基因相对表达量增加,卵黄囊ROS荧光强度减少,β-半乳糖苷酶活性抑制,端粒酶活性增强,SOD,GSH含量增加,血流速度增大,说明该供试品具有抗衰老作用。
【参考文献】
[1] Duran I, Mari-Beffa M, Santamaria JA, et al. Actinotrichia collagens and their role in fin formation[J]. Dev Biol. 2011, 354(1): 160-172.
[2] Gistelinck C, Gioia R, Gagliardi A, et al. Zebrafish Collagen Type I: Molecular and Biochemical Characterization of the Major Structural Protein in Bone and Skin[J]. Sci Rep. 2016, 6: 21540.
[3] Miao M, Bruce A E E, Bhanji T, et al. Differential expression of two tropoelastin genes in zebrafish[J]. Matrix Biology, 2007, 26(2): 115-124.
[4] Kishi S, Bayliss PE, Uchiyama J, et al. The Identification of Zebrafish Mutants Showing Alterations in Senescence-Associated Biomarkers[J]. Plos Genetics. 2008, 4(8): e1000152.
[5] Monique A, Laura M, Francisca A-P, et al.Behaviour of Telomere and Telomerase during Aging and Regeneration in Zebrafish[J]. PLoS One.6(2): e16955.
[6] 劳乔聪, 李春启, 朱凤, 等. 一种斑马鱼体内ROS检测模型的建立方法及其应用: CN201310398791.3[P]. 2013-09-05.
[7] 李美娟, 劳乔聪, 姜永新, 等. 几种植物原花青素及其片段化产物的抗ROS活性评价[J]. 西部林业科学. 2014(1): 99-103.
严正声明:以上内容所涉及的核心知识产权归杭州环特生物科技股份有限公司所有。任意第三方机构或个人在未经授权的前提下抄袭、剽窃、恶意传播均属侵害我司正当权益的行为,我司不排除诉诸一切法律手段维护自身合法权益。