业务咨询

![]() 发布时间:2024-11-22
发布时间:2024-11-22
![]() 环特生物
环特生物
![]() 浏览次数:2591
浏览次数:2591

编者按
准确预测肿瘤扩散风险和治疗效果对于个性化治疗而言至关重要。目前,确定肿瘤侵袭性和扩散性的诊断原则依赖于肿瘤-淋巴结-转移(TNM)分期原则。然而,N或M参数,需要直径为一厘米或更大的病灶,通过医学成像或活检检查来确定。这些评估存在诊断敏感性和特异性较差的问题,因此迫切需要更多的预测方法来评估肿瘤侵袭和扩散。
今天,我们分享2022年2月由瑞典林雪平大学研究团队发表在《Journal of Experimental & Clinical Cancer Research》(IF=11.4)的一项研究成果,该研究开发了将NSCLC PDX材料植入斑马鱼幼鱼的新型稳健方法,表现出优异的植入率并准确地再现了相应小鼠PDX模型和患者本身对紫杉醇和厄洛替尼的反应,可以直接从患者活检中建立ZTX模型,而无需事先在小鼠中进行扩展。基于PDX模型植入的ZTX分析能够准确地概括非小细胞肺癌的药物反应和侵袭表型。
文章题目
Zebrafish patient-derived xenograft models predict lymph node involvement and treatment outcome in non-small cell lung cancer
杂志:Journal of Experimental & Clinical Cancer Research(IF=11.4)
发表时间:2022年2月9日
作者:Zaheer Ali, Malin Vildevall等
单位:瑞典林雪平大学(Linköping University)等
01、研究背景
准确预测肿瘤扩散风险和治疗效果对于个性化治疗而言至关重要。目前,确定肿瘤侵袭性和扩散性的诊断原则依赖于肿瘤-淋巴结-转移(TNM)分期原则。然而,N或M参数,需要直径为一厘米或更大的病灶,通过医学成像或活检检查来确定。这些评估存在诊断敏感性和特异性较差的问题,因此迫切需要更多的预测方法来评估肿瘤侵袭和扩散。
目前,预测肿瘤治疗结果的黄金标准是使用在免疫功能低下的小鼠中生成的患者来源的异种移植(PDX)模型。该模型能更准确的预测患者的反应,且具有高度特征。因此,PDX模型已成为临床前研究非常有价值的资源。然而,PDX模型无法准确评估局部和全身转移。因此需要采用其他方法来获取有关肿瘤扩散和药物抗转移疗效的信息,并将与现有PDX模型相关的其他数据结合起来。
近来,斑马鱼肿瘤异种移植(ZTX)系统已成为肿瘤学和肿瘤生物学研究中一种强大的补充体内系统。通过植入肿瘤细胞系(有时与非恶性肿瘤浸润细胞结合来模拟肿瘤微环境)生成ZTX模型。然而,由于已建立的细胞系可能会随着时间的推移而发生表型漂移,因此这些模型主要用于基础研究或早期临床前药物开发。为了更好地再现患者特异性癌症,ZTX模型是通过直接植入未扩增的患者肿瘤样本而生成的,并被证明可以准确地概括相应患者对两种药物治疗的药物反应概况。
然而,用于此类测试的肿瘤活检是新获得的,因此尚未达到已建立的细胞系或PDX模型的特征。此外,肿瘤活检组织很小,并且在ZTX模型中不会扩大,因此只能用于一项或几项研究,之后患者样本就会被消耗掉。利用冷冻保存的PDX模型作为ZTX平台的起始材料可能会克服这些问题,但目前缺乏将PDX和ZTX相结合的方法。此外,目前尚不清楚由此产生的ZTX模型将在多大程度上保留癌症患者的重要病理生理学特征。
肺癌是所有癌症类型中死亡率最高的。其高死亡率很大程度上是由于当前医疗治疗的效率低下,很少能使患者获得长期缓解,再加上缺乏准确判断全身传播风险的诊断技术。因此,为非小细胞肺癌患者开发新的药物和诊断技术尤为重要。这导致了大量非小细胞肺癌(NSCLC)PDX模型的产生,这些模型反过来又被大量使用和表征。
研究人员开发了将NSCLC PDX材料植入斑马鱼幼鱼的新型稳健方法,表现出优异的植入率并准确地再现了相应小鼠PDX模型和患者本身对紫杉醇和厄洛替尼的反应。可以直接从患者活检中建立ZTX模型,而无需事先在小鼠中进行扩展。基于PDX模型植入的ZTX分析能够准确地概括非小细胞肺癌的药物反应和侵袭表型。
02、研究成果
1. 将冷冻保存的小鼠PDX模型的PDX组织植入斑马鱼幼鱼
为了建立生成斑马鱼肿瘤异种移植(ZTX)模型的方法,研究人员共获得了39个非小细胞肺癌模型。将冷冻保存的组织碎片消化,并与来自相同模型的冷冻保存的细胞悬浮液进行对比。分别消化或解冻后,用荧光染料DiI标记细胞,测定其活力,最后将标记的细胞皮下植入2 dpf斑马鱼幼鱼的卵周间隙(图1A)。在植入后和3天后分别拍摄图像,并确定肿瘤大小的相对变化(图1B和C)。研究人员发现,与先消化组织,冷冻保存为细胞悬浮液然后解冻相比,来自冷冻保存的组织碎片的细胞在解冻后分解,产生的肿瘤存活率更高(图1C)。与细胞悬浮液组相比,组织碎片组中的肿瘤相对于植入时平均增大了2.2倍。因此,研究人员决定在以后的所有实验中使用解冻后分解的冷冻保存的组织碎片。
接下来,对斑马鱼幼鱼的植入效率进行评估。在30个模型中,有25个模型植入成功(n >20)。植入的25个模型在3 dpi时产生的肿瘤平均为植入时大小的64%(图1D),这表明在3天的生长期内,肿瘤细胞死亡在很大程度上被肿瘤增殖所平衡。有趣的是,对于大多数测试模型而言,3 dpi时的相对肿瘤大小与植入前的细胞活力无关,但产生高度增殖肿瘤的三个模型的相对肿瘤大小(相对大小≥100%)确实表现出在植入前具有较高细胞活力的模型中更强劲生长的趋势(图1E)。同样,相对肿瘤大小也与可从样品中提取的细胞数量无关(图1F)。
为了确定ZTX平台的稳健性,由不同的研究人员使用单独的冷冻保存组织碎片重新运行11个模型,并在不同的日子解冻和处理。发现第一次和第二次运行之间ZTX肿瘤的发育总体上没有差异(图1G),这表明ZTX平台是稳定的。
研究人员还评估了所有30个模型中小鼠肿瘤发生和生长的两个重要参数,即肿瘤倍增时间和生长速度,并将其与相应ZTX模型的生长情况进行了比较。结果表明,与ZTX模型类似,小鼠PDX模型表现出不同的生长和摄取率(图1H和I),但与相应ZTX肿瘤的相对生长相关性较差。这是由于一些肿瘤具有高基质含量,并且与肿瘤细胞相比,非恶性基质细胞的增殖能力较低,因此在植入后的几天内对肿瘤生长的贡献较小。同样,虽然模型中的基质含量在4%到30%之间变化,但这与3 dpi时ZTX肿瘤的相对大小无关(图1J)。
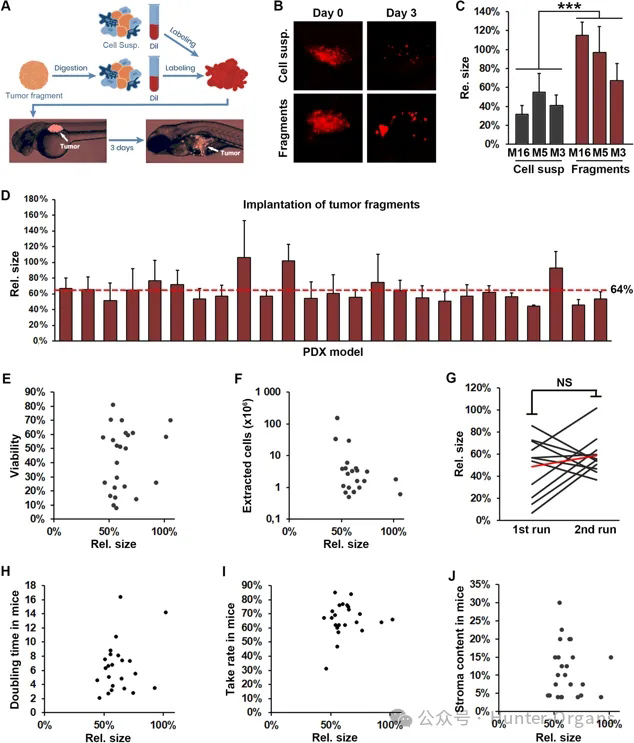
图1
2. 使用ZTX模型可准确重现对标准治疗药物的治疗反应
研究人员对ZTX平台中25个模型的初始队列的药物敏感性和耐药性概况进行研究,并将其与小鼠PDX模型的相应概况进行比较。在肿瘤植入后将斑马鱼培养在紫杉醇和厄洛替尼溶液中3天(图2A)。紫杉醇和厄洛替尼的临床相关剂量分别为20 mg/kg和10 mg/kg,正常斑马鱼在紫杉醇和厄洛替尼在该浓度下均具有耐受性(图2B、C)。
接下来,用厄洛替尼或紫杉醇处理25个模型中每个模型的20尾肿瘤幼鱼,并评估每组在0 dpi与3 dpi时的相对肿瘤大小。将药物治疗组中肿瘤的相对大小与对照组中肿瘤的相对大小进行标准化,得出了模型的相对药物诱导回归的测量值(图2D和E)。厄洛替尼和紫杉醇分别在25个模型中的14个和20个中有效地引起原发性肿瘤消退(图2D和E)。
这些结果反映了与厄洛替尼相比紫杉醇的作用机制更广泛,同时也证明了不同PDX模型对标准治疗的个体反应存在高度差异。随机选择15个模型,并分别确定了其小鼠对厄洛替尼和紫杉醇的药物反应特征。结果表明,厄洛替尼和紫杉醇抑制小鼠肿瘤生长的效力不同,从完全抑制到73.7%抑制(图2F和G)。
重要的是,这些药物在ZTX模型中的功效与其在小鼠PDX模型中的肿瘤生长抑制功效密切相关(图2F和G)。总体而言,ZTX平台能准确再现对非小细胞肺癌PDX模型对标准治疗的反应。
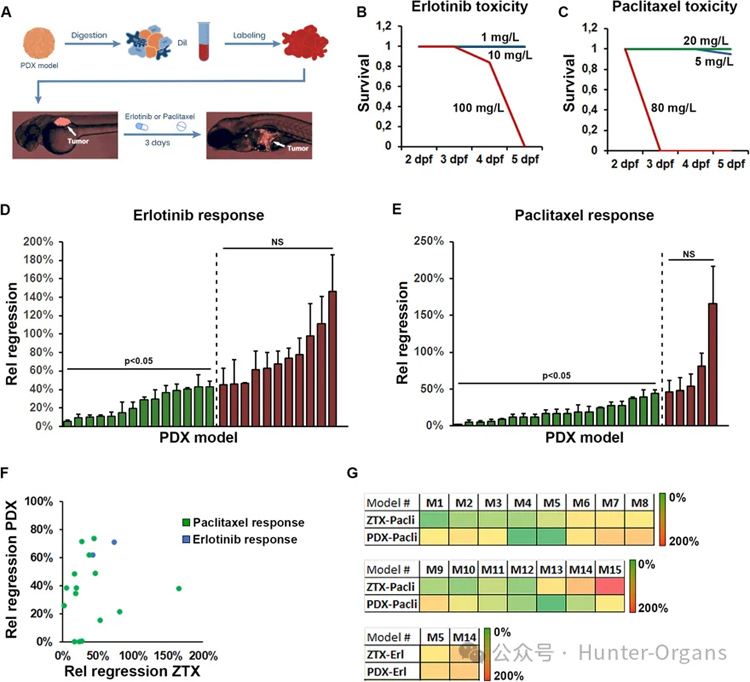
图2
3. 紫杉醇或厄洛替尼的疗效可能是由表观遗传学而非基因决定
接下来,为了研究某些基因突变或基因表达水平的变化是否可以预测对厄洛替尼或紫杉醇的反应与耐药性,研究人员分析了与癌症生物学和病理学相关的37个常见基因的突变谱和表达水平(图3A-C)。发现大多数模型中分析的大多数基因都是野生型,但tp53除外,它在27个模型中有21个发生突变。然而,由于覆盖率较低,某些基因仅进行了部分分析,因此在某些模型中的突变状态尚未确定。将与27个模型的基因突变谱与药物反应谱进行比较,发现无论是厄洛替尼还是紫杉醇,都没有明确的基因突变模式赋予其敏感性或耐药性(图3A)。
研究人员通过RNA测序进一步检查了该组中另外36个基因的表达水平(图3B和C)以比较敏感模型和耐药模型中的表达,发现P53抑制因子Mdm2、音Patched1和mTOR抑制剂TSC1的过度表达与厄洛替尼耐药相关(图3B)。类似地,Patched1和NRAS的过表达与紫杉醇耐药性相关,而ERBB2和FOX-A的过表达与紫杉醇反应显著相关(图3C)。
这些结果表明,Patched1的高表达可能会导致肺癌患者对一线治疗产生耐药性,这一假设应在未来的临床研究中进一步研究。
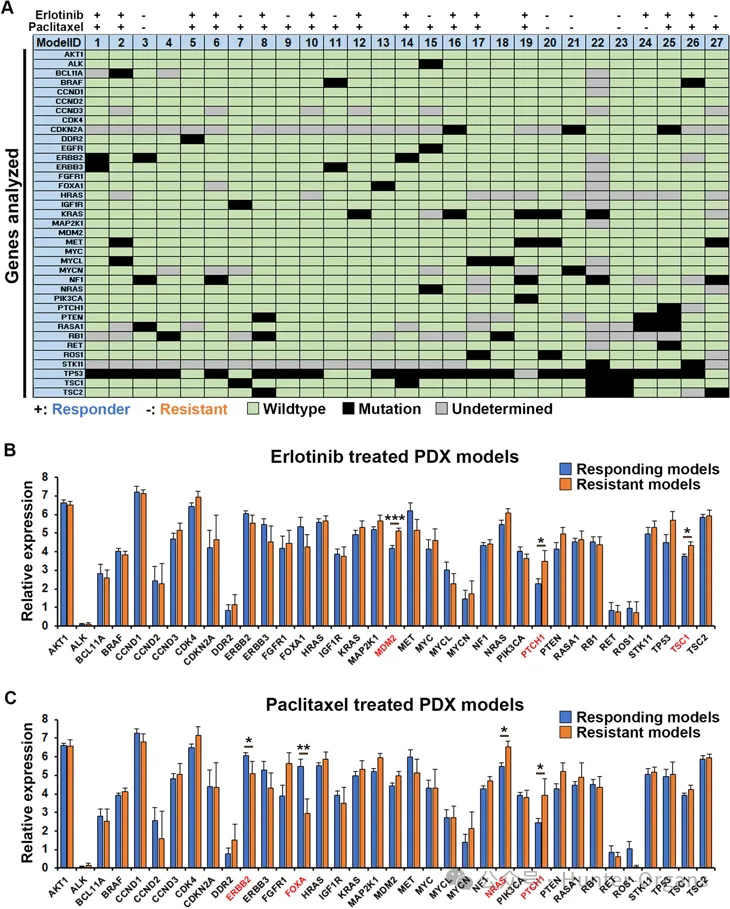
图3
4. 药物诱导的肿瘤扩散抑制与肿瘤疗效无关
ZTX模型的主要优点之一是可以评估早期肿瘤侵袭和扩散。为了研究ZTX平台是否也可以使用PDX模型确定患者肿瘤的侵袭性和扩散性,研究人员将最初的25个可植入PDX模型中生成的细胞植入斑马鱼幼鱼。在3 dpi时评估尾部造血丛主要转移灶中出现的标记肿瘤细胞数量(图4A-C)。
结果表明,这些模型在ZTX系统中表现出高度异质性的转移能力(图4C)。虽然模型的EMT评分和基质含量与斑马鱼中接种的转移细胞数量无关(图3D和E),但PDX模型在植入斑马鱼幼鱼之前的较高血管化程度明显与转移细胞的增加接种有关(图4F),这表明与EMT评分或基质含量相比,模型的血管生成特性与其转移扩散更密切相关。
接下来,研究人员通过评估每种植入模型治疗后的转移反应来评估厄洛替尼和紫杉醇的抗转移功效。虽然这些治疗在某些模型中抑制了转移扩散(图4B和G),但在测试的26个模型中的大多数模型中,它们在这方面无效。
为了评估抗转移功效是否与药物在ZTX平台中引起原发性肿瘤消退的能力相关,绘制了载体组中肿瘤大小的变化与转移细胞数量的关系(图4H)以及厄洛替尼或紫杉醇治疗模型的抗肿瘤功效与抗播散功效的对比(图4I和J)。结果表明,肿瘤生长和转移率之间不存在相关性(图4H)。
然而,令人惊讶的是,对于两种测试药物中的任何一种,药物诱导的肿瘤消退的效力与药物诱导的肿瘤扩散抑制的效力并没有密切相关(图4I和J),尽管这种相关性的趋势可能会增加。从厄洛替尼治疗的模型中可以看出(图4I)。这表明EGFR阻断可能在更大程度上抑制敏感模型中的肿瘤生长和扩散,而在紫杉醇治疗的模型中对肿瘤生长和扩散的影响似乎彼此不相关。
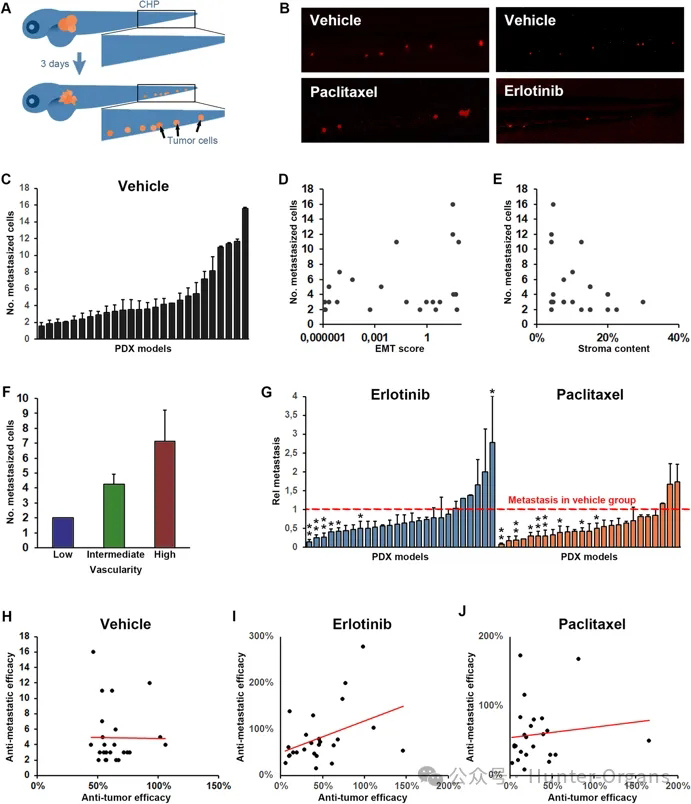
图4
5. ZTX模型中的肿瘤扩散可高度预测患者体内的肿瘤扩散情况
接下来研究了ZTX模型在多大程度上重现了该模型所源自的患者的侵袭性肿瘤表型。在初始研究中使用的30个模型中,12个来自LN-的患者,16个来自LN+的患者。其余两名患者缺乏此类信息(图5A)。
在植入斑马鱼幼鱼的25个模型中,15个来自LN+患者,9个来自LN-患者,其中一个来自淋巴结状态未知的患者。有趣的是,与源自LN-患者的模型相比,源自LN+患者的PDX模型在ZTX平台中移植的转移细胞平均多出2.1倍(图5B和C)。在ZTX平台中接种5个或更多转移细胞的七个模型均源自LN+患者,这意味着在此临界值下可以以100%的灵敏度积极预测淋巴结转移(图5C和D)。
此外,在接种少于5个转移细胞的17个模型中,有9个来自LN-患者,导致在此临界值下的诊断特异性为53%。为了进行比较,最佳临床标准,即肿瘤(T)分期,与该患者队列中的淋巴结转移无关(图5E)。其他但在所有病例中较弱的淋巴结受累指标包括与腺癌或鳞状细胞癌相比被诊断为大细胞癌的患者(图5F)以及具有中度或低分化肿瘤的患者(图5G),诊断时年龄较小(图5H)且为女性(图5I)。
然而,与LN-患者相比,小鼠PDX模型的侵袭特征,包括基质含量、血管分布和EMT评分,在LN+患者中没有显着差异(图5J和L)。综合起来,这些发现强烈表明,由冷冻保存的PDX材料生成的ZTX模型能够密切再现患者肿瘤的侵袭性表型,并以比当前临床金标准更高的灵敏度预测淋巴结转移。
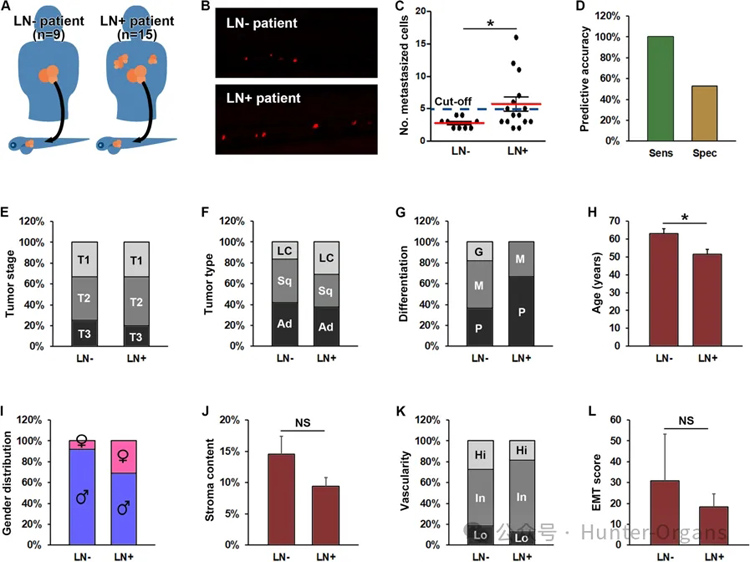
图5
6. ZTX模型的药物反应可高度预测患者的药物反应
为了进一步验证30个PDX模型的初始队列中的研究结果,并进一步比较ZTX模型中的治疗结果与在患者中观察到的结果,研究人员获得了9个PDX模型(图6A-C),其中患者的治疗结果是已知的,这些模型对厄洛替尼和紫杉醇表现出不同的反应。
五个模型源自厄洛替尼治疗后复发的患者,另外三个模型来自紫杉醇治疗后复发的患者(均未获得缓解)。这八个模型对ZTX平台中的厄洛替尼和紫杉醇具有类似的耐药性,从而证明ZTX与患者治疗结果之间具有100%的相关性(图6A和B)。只有一个来自局部癌症患者,该模型在ZTX模型中表现出低于临界值的扩散。在源自患有已知转移性疾病的患者的四种模型中,三种表现出高于临界值的扩散,而一种则没有(图6C)。因此,在PDX模型的验证中,ZTX系统中的正确预测患者的转移性的准确度为80%。
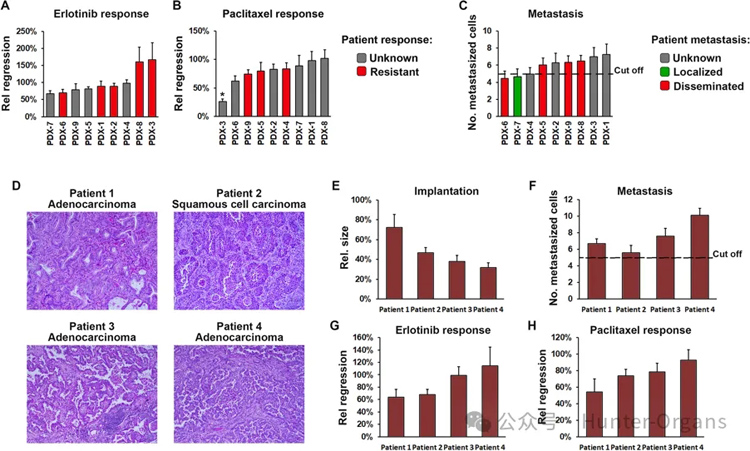
图6
7. ZTX模型可以直接从NSCLC患者活检中建立
接下来,为了确定是否可以将新鲜收集的非扩展NSCLC患者活检组织植入斑马鱼胚胎中,研究人员开展了一项临床概念验证研究,招募了四名患者。其中三名患者被诊断患有腺癌,而一名患者被诊断患有鳞状细胞癌(图6D)。所有四名患者样本均植入斑马鱼胚胎中,尽管植入后3天时肿瘤的相对大小略低于使用PDX模型时的大小(图6E)。
所有ZTX模型均表现出高于临界值的扩散,这表明患者可能患有淋巴结阳性或转移性疾病。不幸的是,所有四种ZTX模型也对厄洛替尼和紫杉醇均具有耐药性,这表明患者可能无法从这些治疗中获得治疗益处。虽然需要进行更大规模的前瞻性研究来确定基于直接使用肿瘤活检建立 ZTX模型来预测NSCLC患者治疗结果和淋巴结转移的准确性,但这项概念验证研究证明了这种方法的可行性方法。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,胃癌、脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!