业务咨询

![]() 发布时间:2025-07-09
发布时间:2025-07-09
![]() 环特生物
环特生物
![]() 浏览次数:1517
浏览次数:1517

编者按
近年来,基因编辑技术的发展为生命科学研究带来了革命性的变化,特别是CRISPR-Cas13 RNA靶向系统在基础和应用科学中被广泛使用,成为了科研人员的有力工具。然而,在哺乳动物细胞和小鼠模型中出现的旁切效应,及在体内的靶向能力还有待提高,效率不稳定等因素,限制了其在体内的应用。
今天,我们分享2025年3月由西班牙安达卢西亚发育生物学中心等研究团队联合在Nature Communications(IF=16.6)上发表的最新研究成果。该研究提供了一套优化的、经过验证的策略工具箱,通过瞬时方法优化了斑马鱼中RNA靶向CRISPR-Cas技术,显著提升了在斑马鱼中进行高效、特异、安全的RNA靶向研究的潜力,为CRISPR-Cas技术在体内的应用提供了新思路、新方法,并为更广泛的潜在治疗铺平了道路。
文章题目
Enhanced RNA-targeting CRISPR-Cas technology in zebrafish
杂志:Nature Communications(IF=16.6)
发表时间:2025年3月16日
作者:Ismael Moreno-Sánchez,Ariel A. Bazzini & Miguel A. Moreno-Mateos et al.
单位:西班牙安达卢西亚发育生物学中心、西班牙巴勃罗.德.奥拉维德大学、西班牙神经科学研究所等
DOI: 10.1038/s41467-025-57792-9
01、研究亮点
• 通过瞬时方法提出了五种互补的斑马鱼RNA靶向的CRISPR-Cas技术优化策略,cm-gRNA、NLS组合优化、IVTed gRNA毒性筛查、RNAtargeting模型预测、替代系统等;
• 通过斑马鱼胚胎模型评估并优化了RNA靶向的CRISPR-Cas技术,旨在解决应用中存在的晚期基因靶向效率低、部分体外转录gRNA毒性、核RNA靶向困难、gRNA活性预测不准、附带活性无法表征等问题,显著增强了斑马鱼中RNA靶向CRISPR-Cas技术的效率和适用性;
• 一整套技术创新策略,为CRISPR-Cas13技术在基于RNA敲降的生物技术和生物医学治疗应用,尤其是瞬时递送场景中的安全性和有效性提供了重要依据和优化策略。
02、研究背景
RfxCas13d是一种来自黄化瘤胃球菌XPD3002的Cas13d蛋白(CasRx)的II类/VI型CRISPR-Cas RNA核酸内切酶,它与向导RNA(gRNA)一起通过RNA-RNA杂交靶向RNA。CRISPR-RfxCas13d系统已被广泛用于消除RNA,在生物技术及医学领域具有巨大的潜力。研究人员最近利用核糖核蛋白(RNP)复合物或mRNA-gRNA递送技术,在体内优化了CRISPR-RfxCas13d技术,使其可以在斑马鱼、青鳉鱼、小鼠等动物胚胎中实现有效、瞬时和细胞质mRNA敲降(KD)。这些方法也被用于标记斑马鱼胚胎生成过程中的mRNA,扩展了该技术在体内的应用。
然而,研究人员通过探究确定了晚期基因靶向效率低、部分体外转录gRNA毒性、核RNA靶向困难、gRNA活性预测不准、附带活性无法表征等一系列待解决的限制因素,以进一步扩展CRISPR-RfxCas13d系统在体内的能力。
本研究使用斑马鱼模型的不同方法,在体内增强RNA靶向CRISPR-Cas技术,并优化了瞬时递送制剂,作为核糖核蛋白复合物RNP或mRNA-gRNA组合,以增强CRISPR-RfxCas13d系统在斑马鱼中的效果。i) 使用化学修饰的gRNA(cm-gRNA),以获得更显著的基因功能缺失表型;ii) 改进核RNA靶向; iii) 比较不同的计算模型,并确定最准确的模型来预测体内gRNA活性。此外,研究发现除靶向丰富和异位表达的RNA之外,瞬时CRISPR-RfxCas13d可以有效减少斑马鱼胚胎中的内源性mRNA,而不会诱导旁切效应。最后,通过实现替代RNA靶向的CRISPR-Cas系统,如CRISPR-Cas7-11、CRISPR-DjCas13d。
总之,这些发现通过瞬时方法优化了斑马鱼中RNA靶向的CRISPR-Cas技术,对更好地理解和增强斑马鱼中的CRISPR-Cas技术做了重要贡献,也将促进RNA靶向CRISPR-Cas更有效地应用于生物技术及医学研究。
03、研究结果
1. CRISPR-RfxCas13d向导RNA优化,在斑马鱼胚胎中实现简单、持续的靶向作用
在斑马鱼胚胎发育中,CRISPR-RfxCas13d对靶向内源性和早期转录的mRNA表现出较高活性,但当受精后7-8小时后,其基因表达效率较低。通过靶向斑马鱼胚胎中不同内源性的mRNA和合子转录mRNA,可视化并量化基因功能缺失表型(图1B–G),实验结果表明,化学修饰的cm-gRNA与RfxCas13d mRNA联用,能显著提高CRISPR-RfxCas13d对斑马鱼胚胎发育后期(7-8 hpf后)表达的合子基因mRNA的敲降效率和表型外显率,克服了RNP复合物在此方面的不足。
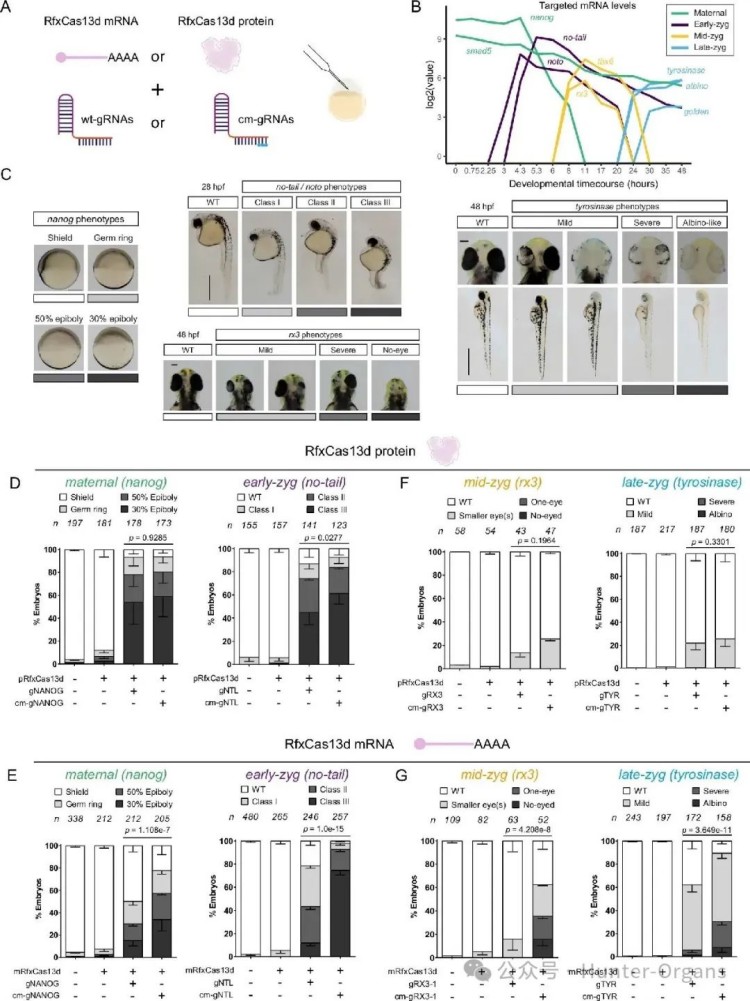
图片图1 斑马鱼胚胎中CRISPR-RfxCas13d的靶向作用
此外,进行体外转录(IVTed gRNAs)时,观察到一部分RfxCas13d在斑马鱼胚胎中引起发育迟缓、死亡等严重的发育毒性,一些经静脉注射的RfxCas13d gRNA可能会在体外和体内诱导28S rRNA断裂,这与胚胎生成过程中的严重缺陷和毒性有关。
为了探究毒性效应是源于体外转录合成还是gRNA序列本身,研究人员使用靶向mRNA的化学合成gRNA1和gRNA3进行实验,发现相同序列的化学合成gRNA无毒且有效,揭示了该毒性源于IVT过程本身,而非gRNA序列本身,也非5'三磷酸或干扰素反应。本研究开发了一种简单快速的体外rRNA完整性检测方法,通过使用化学合成的gRNAs 或对IVTed gRNAs,可用于预筛IVTed gRNA的潜在毒性。
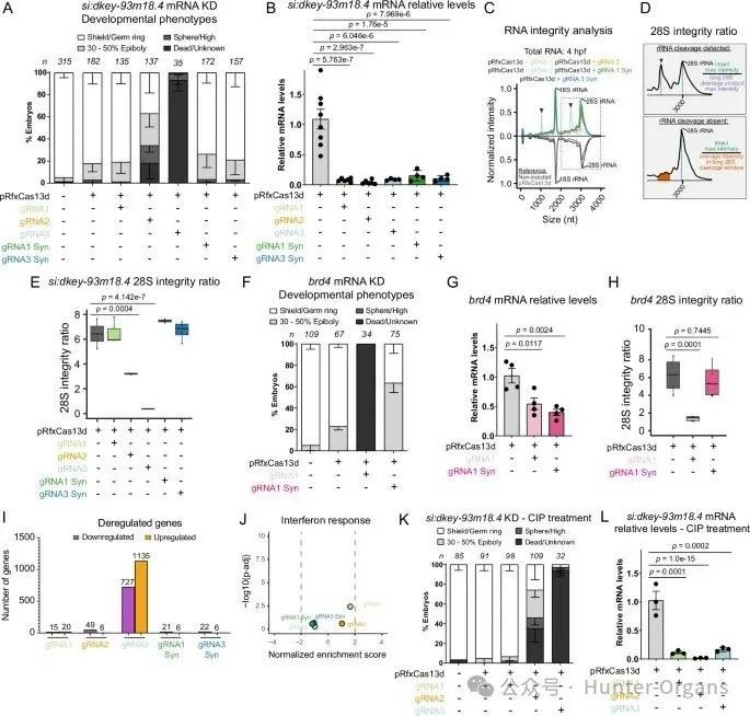
图片图2 体外转录的gRNA会引起毒性效应
2. 在斑马鱼胚胎中增强CRISPR-RfxCas13d对核RNA的耗竭
高效的核RNA靶向对消除细胞区域中的RNA至关重要,如长链非编码RNA或微小RNA(microRNA)。为了提高核RNA的靶向能力,研究人员对RfxCas13d进行了优化,带有核定位信号(NLS,RfxCas13d-NLS)的RfxCas13d在斑马鱼胚胎中的活性大幅降低。
通过测试4种不同的NLS组合,研究人员确定了在RfxCas13d C端添加SV40-核质蛋白长NLS(RfxCas13d-2C-NLS)的mRNA-gRNA递送方案,能有效靶向并敲降斑马鱼胚胎中的核RNA,如初级miR-430转录本pri-miR-430和snRNA u4atac,并引发预期的发育表型和分子效应,如miR-430靶标mRNA稳定化等。
总之,实验结果表明,作为mRNA-gRNA制剂使用的CRISPR-RfxCas13d-2C-NLS系统能有效耗竭斑马鱼胚胎中的核RNA,优化核定位可以增强对核RNA的靶向和降解作用。
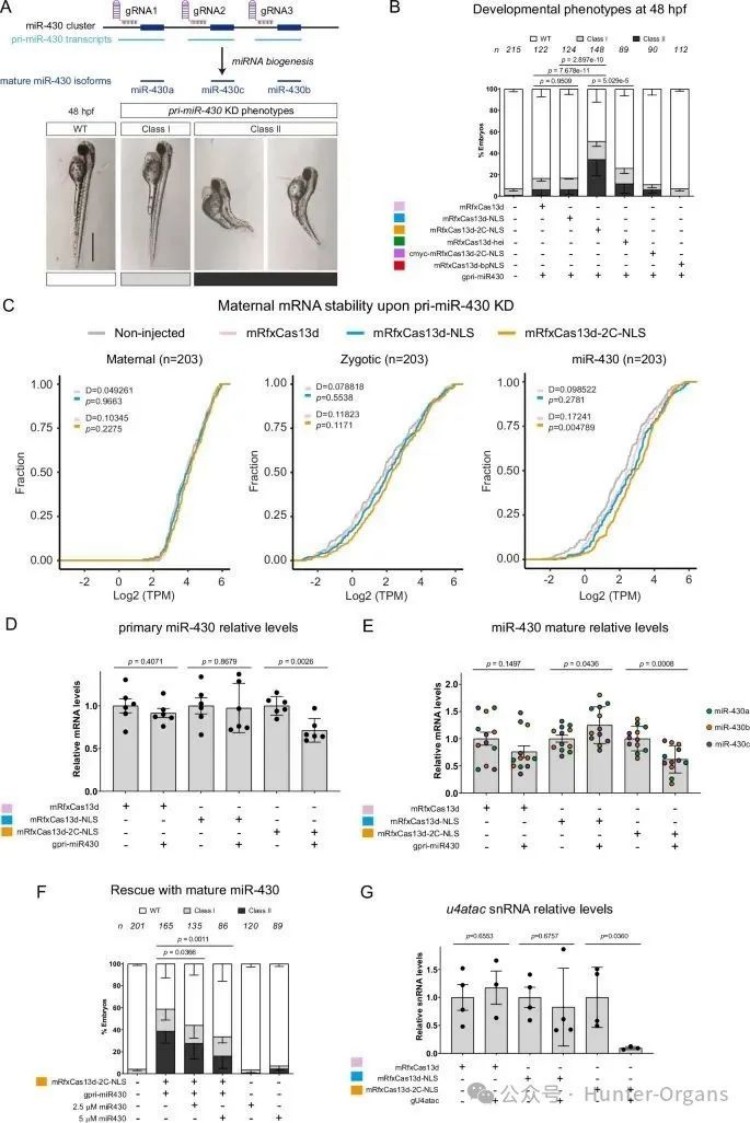
图片图3 优化的定位信号增强CRISPR-RfxCas13d核RNA靶向能力
3. 基于体外计算模型可预测体内CRISPR-RfxCas13d活性
最近基于RfxCas13d 和gRNA在哺乳动物细胞培养中的数据,开发了几种计算模型来预测CRISPR-RfxCas13d活性。为了验证gRNA活性预测模型的效果,研究人员基于RNP复合物的优化瞬时方法,在斑马鱼胚胎中系统评估了约200个gRNA的体内活性。
实验结果显示,RNAtargeting能以与对照组的体外数据相似甚至更高的准确度分类八组gRNA中的五组,且RNAtargeting是区分高效(每组前5名)和低效(每组后5名)gRNA的最有效计算模型(图 4C–E)。这些结果表明,RNAtargeting是目前选择高效gRNA的最有用工具。然而,RNAtargeting在预测CRISPR-RfxCas13d RNP活性方面,八组gRNA 中有三组的活性预测准确性较低。
这表明,尽管在部分gRNA组中表现不佳,但RNAtargeting模型在预测和分类CRISPR - RfxCas13d 核糖核蛋白(RNP)复合物活性方面表现最佳,是适度、准确地预测CRISPR - RfxCas13d在体内活性的最佳工具。
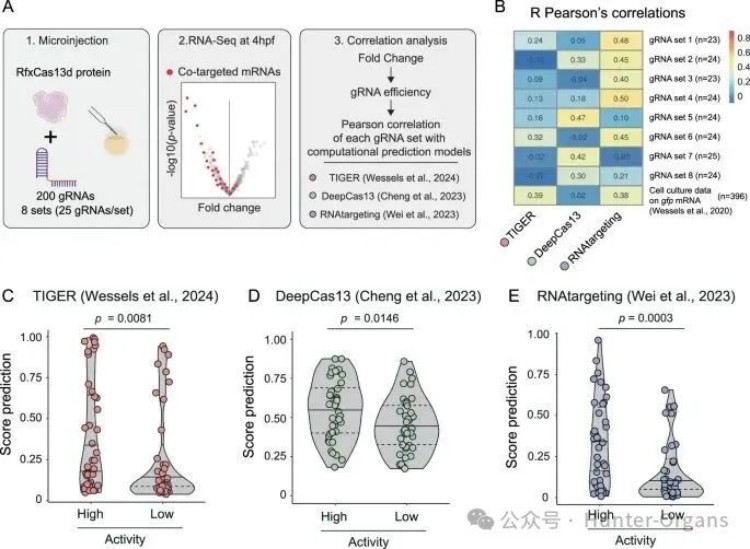
图片图4:基于体外计算模型可以适度预测CRISPR-RfxCas13d在体内的活性
4. CRISPR-RfxCas13d靶向内源性mRNA的附带活性
CRISPR-RfxCas13d诱导的附带活性导致不同的分子结果,从而引起在特异性靶向外源和内源转录本后RNA的失控消除,且其附带活性在靶向高表达基因时最严重,并最终导致细胞毒性、细胞增殖减少和28S rRNA断裂等。
研究人员发现,当使用RNP或mRNA-gRNA瞬时递送的CRISPR-RfxCas13d系统,靶向高浓度的报告基因,如绿色荧光蛋白GFP的mRNA 时,会引发附带活性,导致胚胎发育缺陷、28S rRNA 裂解以及转录组的全局失调。
但当靶向斑马鱼胚胎中的内源性mRNA时,即使是高丰度内源性基因,CRISPR-RfxCas13d的附带活性也极小,仅引起极轻微的28S rRNA断裂,未观察到发育缺陷或显著的转录组全局失调,表明其具有高度特异性,其附带活性没有明显的生理影响。然而,靶向注射的高丰度外源报告mRNA (gfp mRNA) 时,会触发剂量依赖性的附带活性,导致28S rRNA断裂、共注射报告基因(DsRed)的非特异性敲降、严重的转录组全局失调,如大量基因上调、下调等,以及发育缺陷、死亡,且这种效应在RNP递送时更严重。
值得注意的是,即使在最低浓度的gfp mRNA中,尽管在敲降(KD)后未观察到发育延迟,但仍可以明显观察到28S rRNA的断裂,这表明体外RNA完整性检测在检测CRISPR-RfxCas13d诱导的附带活性时非常敏感。
总之,实验结果表明,即使在斑马鱼胚胎发育过程中靶向高丰度的内源性mRNA时,作为RNP或mRNA-gRNA复合物使用的CRISPR-RfxCas13d的副作用也是极小的,没有生理影响,但当靶向高丰度外源报告mRNA,如注射报告基因时,就会触发剂量依赖性的附带活性。
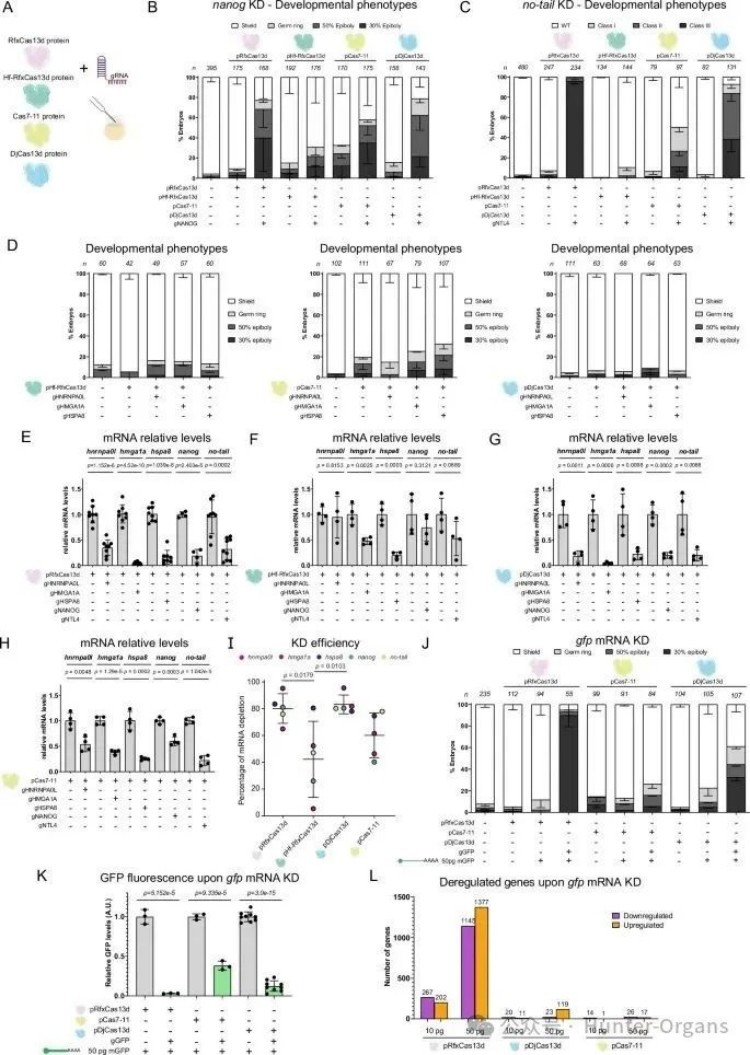
图片图5 CRISPR-RfxCas13d靶向斑马鱼胚胎内源性mRNA的附带活性
5. 体内瞬时RNA靶向的替代CRISPR-Cas系统
尽管在靶向内源性mRNA时其附带活性较小,但某些情况下,RfxCas13d引发的附带活性仍可能会影响其在体内的应用。因此,研究人员对RNA靶向的CRISPR - Cas7 - 11、CRISPR - DjCas13d 和高保真版本的 RfxCas13d(Hf - RfxCas13d)等CRISPR-Cas系统进行了评估。
研究结果显示,CRISPR-DjCas13d (RNP)在靶向效率上与RfxCas13d相当,但在靶向超高丰度外源gfp mRNA时,引起的发育缺陷、DsRed敲降等附带活性低于RfxCas13d,且未检测到28S rRNA断裂。在本研究条件下,其IVTed gRNA未显示毒性;CRISPR-Cas7-11 (RNP)几乎检测不到附带活性,无发育缺陷、无28S断裂、无DsRed敲降、无显著转录组失调,但其靶向效率低于RfxCas13d和DjCas13d。而RNP或mRNA-gRNA注射的CRISPR-HF-RfxCas13d,在瞬时递送条件下效率显著低下,不适用于此场景。
总之,实验结果表明:(i) CRISPR-RfxCas13d 是一种高效、特异且可靠的测试斑马鱼胚胎靶向内源性mRNA的方法;(ii) CRISPR-Cas7-11和CRISPR-DjCas13d RNP可以作为替代系统使用,它们在靶向极丰的异位RNA时,表现出略低于或与 CRISPR-RfxCas13d相似的靶向活性,且附带活性较低或不存在。
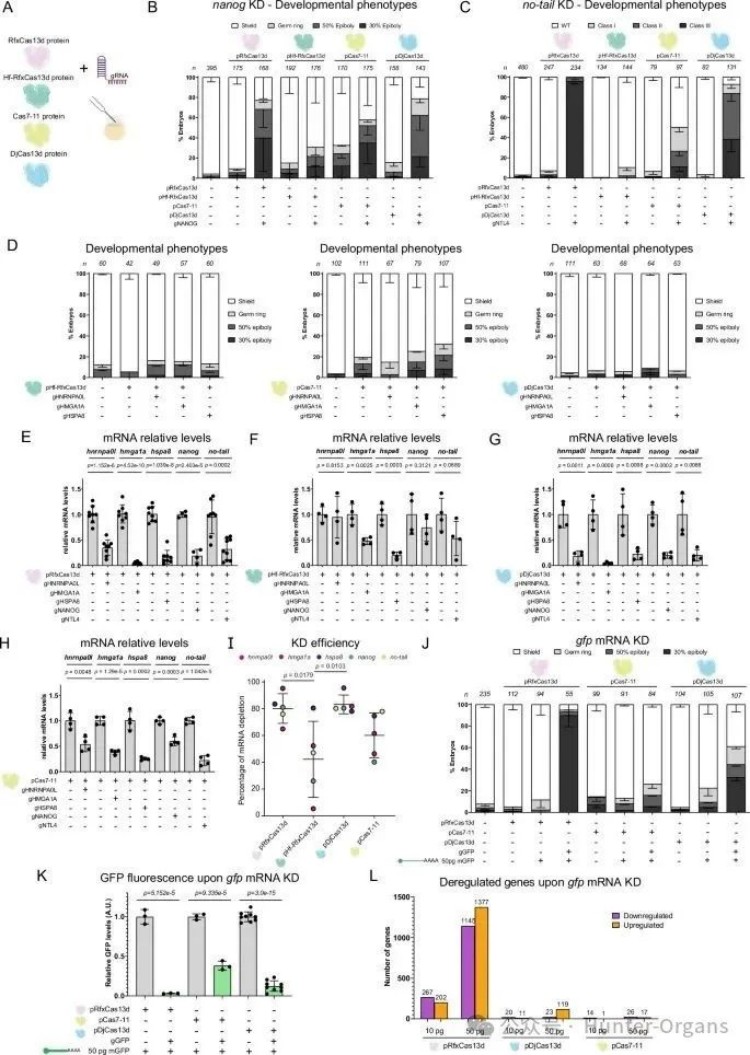
图片图6 体内瞬时RNA靶向的替代CRISPR-Cas系统
04、编者点评
本研究通过多种优化策略,如cm-gRNA、NLS组合优化、IVTed gRNA毒性筛查、RNAtargeting模型预测、替代系统等,显著增强了CRISPR-Cas13d,特别是RfxCas13d在斑马鱼胚胎模型中瞬时靶向RNA的效率、特异性和安全性。而且,揭示了在靶向内源mRNA、瞬时递送等生理相关条件下,CRISPR-RfxCas13d的附带活性极低且无生理影响,为规避潜在毒性、核靶向、效率预测等问题,寻求更低附带活性的替代方案DjCas13d, Cas7-11提供了实用指南。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、基因编辑、类器官、哺乳动物、人体”等多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,胃癌、脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!