业务咨询

![]() 发布时间:2023-07-14
发布时间:2023-07-14
![]() 环特生物
环特生物
![]() 浏览次数:5569
浏览次数:5569

编者按
黑色素瘤是最具侵袭性的癌症之一,具有很高的死亡率。现有的治疗干预手段包括免疫检查点阻断疗法、靶向疗法和肿瘤浸润型淋巴细胞(TILs)疗法。由于肿瘤异质性,只有少数的黑色素瘤患者能从免疫疗法中长期获益。因此,一种能够研究耐药性机理以及改善治疗效率的黑色素瘤临床前体外模型,就显得尤为重要了。
今天我们解读一项于2023年5月22日发表在《eBioMedicine》的最新研究——《Patient-derived melanoma organoid models facilitate the assessment of immunotherapies》,作者介绍了两种构建患者来源的黑色素瘤类器官(MPDOs)的方法,分别是气液界面培养和基质胶培养,并以此来评价免疫疗法对肿瘤细胞的杀伤效果,并进一步用以增强免疫疗法疗效的小分子物质的筛选。
一、 研究背景
黑色素瘤是最具侵袭性的癌症之一,具有很高的死亡率[1]。现有的治疗干预手段包括免疫检查点阻断免疫疗法、靶向疗法和肿瘤浸润型淋巴细胞疗法,上述疗法均已被证明具有一定临床价值[2,3]。然而多数的病患对治疗没有应答或者很快发展出耐药性。
究其原因,肿瘤的异质性干扰了一些介入手段的疗效[4]。动物异种瘤模型(PDX)无法重现肿瘤微环境,且成瘤时间较长(2-11月),另外还有宿主动物免疫细胞浸润肿瘤的问题,造成实验结果在人体上的阳性率不足10%[5]。基于3D细胞培养技术的类器官模型在很大程度上补充了PDX模型的缺陷。黑色素瘤有其独特的肿瘤微环境,病灶部位的细胞类型常包括丰富的肿瘤浸润性免疫细胞(TILs)和基质细胞[6],这对肿瘤的进展和药物的疗效都有巨大的影响[7, 8]。
研究者以两种不同的培养方法构建黑色素瘤类器官(MPDOs),在体外模拟肿瘤微环境(TME)。用基质胶包埋和气液界面接种的培养方法构建的MPDOs模拟了肿瘤的异质性,且含有不同类型的免疫细胞。作者测试了PD-1抗体的免疫疗效,结果显示,PD-1抗体能激活CD8+ T细胞,进一步造成MPDOs中肿瘤细胞的死亡。作者发现对比其他方法,TILs在IL-2和PD-1抗体的共激活作用下扩增明显,且能更好地浸润MPDOs,并杀死黑色素瘤细胞。作者通过药物筛选实验还发现小分子Navitoclax能进一步提升TILs的免疫治疗效果。
二、 研究结果
1、 MPDOs与亲本肿瘤组织的一致性鉴定
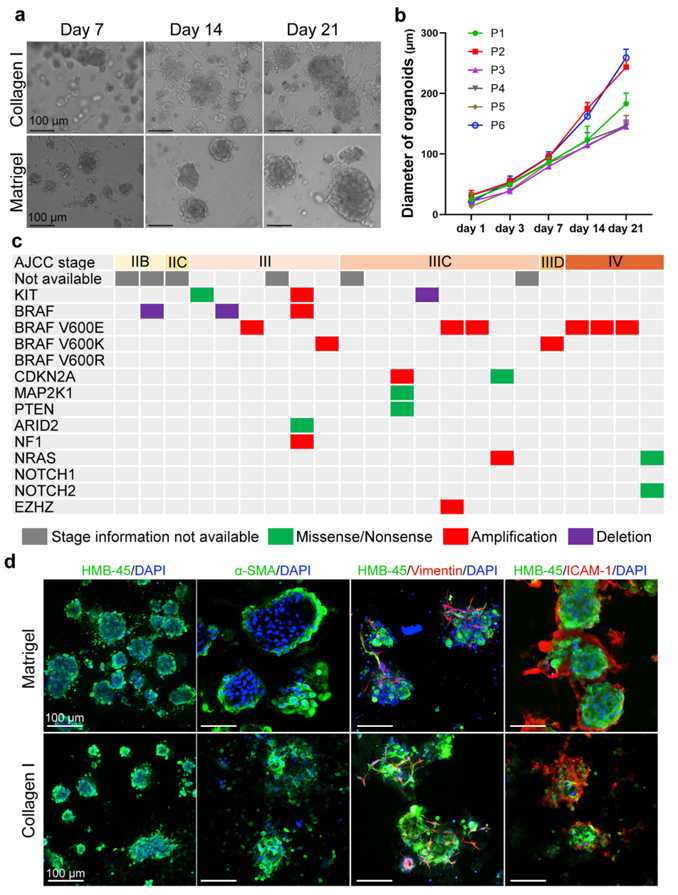
原文图 1 MPDOs与亲本组织的一致性鉴定
作者用两种方法构建MPDOs,分别是基质胶包埋法和气液界面法,一共处理了30例新鲜的黑色素瘤组织样本,成功率约为73%,培养出的类器官可多次传代、复苏,一代中,最多可培养至一个月左右。并且两种方法构建的类器官在外形上没有明显的区别。作者通过测序鉴别各例样本的肿瘤分期和突变情况,发现MPDOs的构建成功率和肿瘤分期及突变情况无关。作者还通过免疫荧光在两种方法构建的类器官中都鉴定出了黑色素瘤标志物:HMB-45,以及与原代肿瘤组织相似的构成细胞类型:α-SMA标记的成纤维细胞、波形蛋白(Vimentin)标记的间充质细胞,以及细胞间粘连蛋白(ICAM-1),说明了MPDOs与亲本组织具有高度的一致性。
2、 MPDOs中有多种类型的免疫细胞
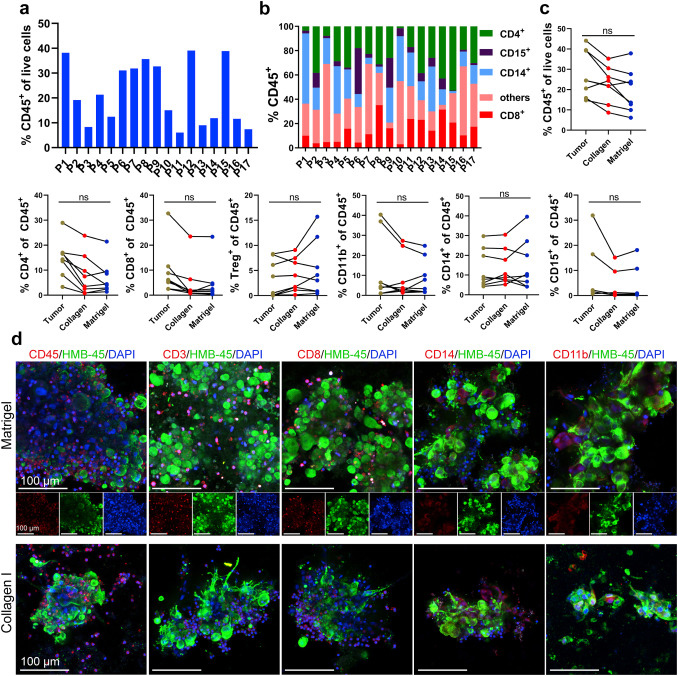
原文图 2 MPDOs保留了原有组织中的多种类型免疫细胞
作者通过流式细胞术和免疫荧光染色,发现两种方法构建的MPDOs中都有多种免疫细胞,但各种免疫细胞的比例在不同患者来源的MPDOs间存在差异,可能由肿瘤的异质性引起。对比亲本组织,MPDOs中各种免疫细胞的占比无显著性差异,以上结果说明短期的培养(7天内),MPDOs仍能保持与亲本组织类似的免疫微环境。
3. MPDOs中免疫抑制性的肿瘤微环境(TME)
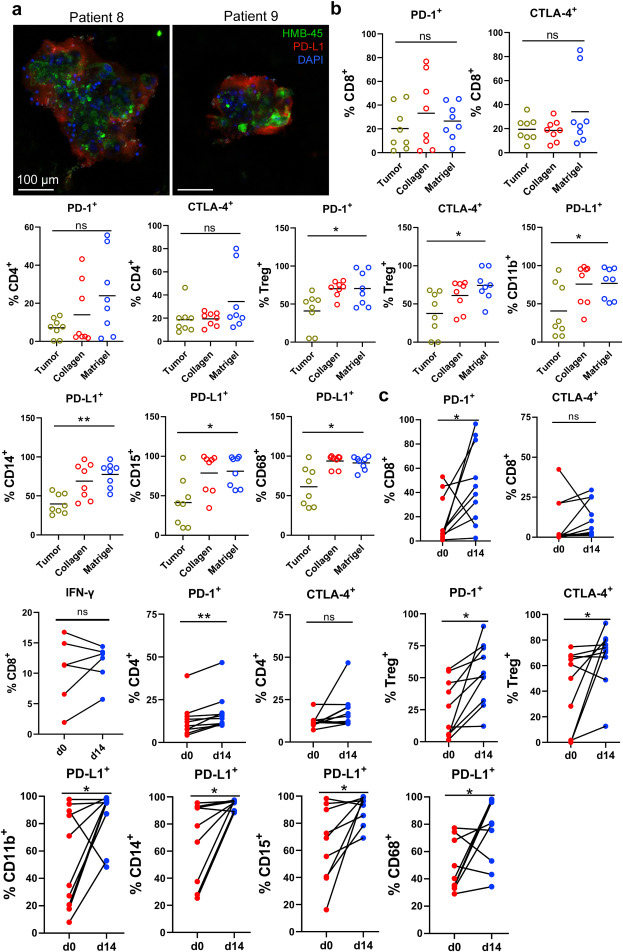
原文图 3 MPDOs中的免疫抑制肿瘤微环境
黑色素瘤组织有着免疫抑制的肿瘤微环境。肿瘤细胞通过过表达PD-L1等免疫检查点蛋白达到免疫逃逸的目的。作者通过免疫荧光染色确认,MPDOs中有PD-L1的表达,这与亲本肿瘤组织非常类似。通过流式细胞术确认,PD-1和CTLA4在MPDOs中的CD4+和CD8+ T细胞和调节性T细胞(Terg)中都有表达,并且基于基质胶3D培养的MPDOs中PD-L1在CD11b+、CD14+和CD15+等髓系单核细胞以及CD68+巨噬细胞中的表达量显著高于其亲本组织。值得注意的是经过14天的培养,PD-1和PD-L1在MPDOs中的免疫细胞上的表达量显著上升。以上结果说明,构建的MPDOs能模拟亲本组织的免疫抑制性肿瘤微环境。
4. PD-1抗体促进TILs的扩增和杀伤能力
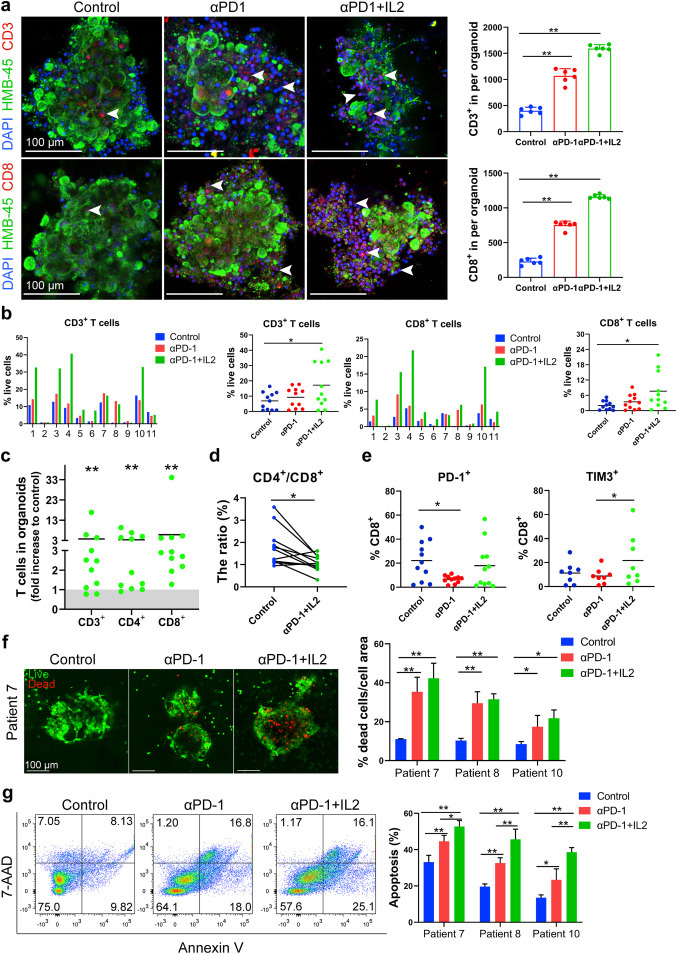
原文图 4 PD-1抗体和IL-2共激活MPDOs中的CD8+ T细胞
作者接下来评价了PD-1抗体对MPDOs中免疫细胞扩增的促进作用及其对MPDOs中肿瘤细胞的杀伤能力。作者首先对患者亲本肿瘤组织和健康捐赠者PBMC中CD8+ T细胞上免疫检查点相关蛋白(PD-1,CTLA-4,TIM-3和PD-L1)的表达水平进行比较,发现就如之前所报道的那样,前者的表达水平显著高于后者的,大约是后者的4-10倍。
作者接下来通过免疫荧光染色实验发现,PD-1抗体和IL-2的联用显著增加了该组MPDOs(基质胶培养)中CD3+和CD8+ T细胞数量。该指标约是对照组的5.5倍,在和单独使用PD-1抗体组比较时也呈现类似的增加趋势。并且,MPDOs中活的肿瘤细胞随着其中CD3+和CD8+ T细胞的扩增而减少,导致长成的MPDOs的尺寸变小。进一步通过流式细胞术,作者确认了PD1抗体和IL2联合组更能促进CD3+、CD4+和CD8+ T细胞的扩增,并且降低了CD4+和CD8+的比值。对随机选取的三例患者的细胞杀伤能力和细胞凋亡检测,证实了PD-1抗体和IL2联用组对肿瘤细胞更强的杀伤效果。
5、 IL-2和PD-1抗体联用扩增的TILs用于免疫疗法
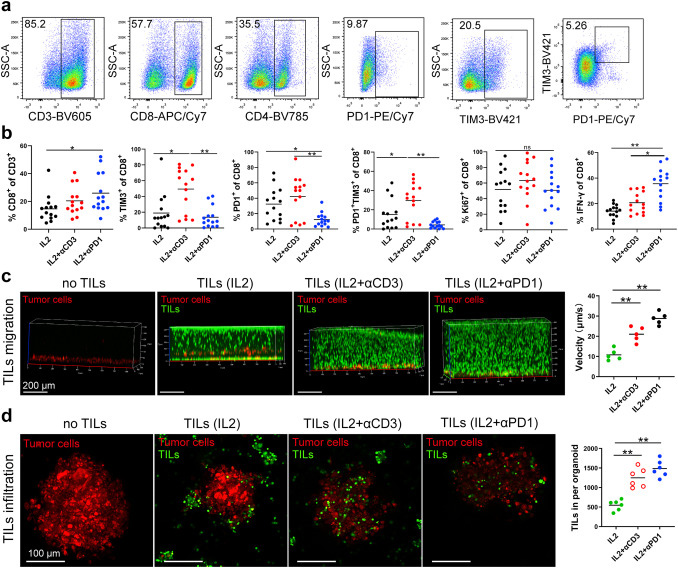
原文图 5 TILs的迁移和浸润
传统的过继性细胞疗法(ACT)中,TILs的激活多采用IL-2+CD3抗体,作者基于前面的研究结果,认为IL-2+PD-1抗体能增强TILs的扩增和杀伤能力。作者利用流式细胞术发现,IL-2与PD-1抗体联用后,对比单用IL-2或者IL-2+CD3抗体,TILs中CD8+ T细胞数量显著增加,CD8+和CD4+ T细胞中免疫检查点相关蛋白PD-1、Tim-3的表达量显著降低,CD8+ T细胞中IFN-γ的表达显著增加,说明了PD-1抗体的存在对TILs的扩增可能发挥了促进作用。
作者接下来研究了IL-2+PD-1抗体对TILs趋化性和迁移能力的影响。通过将MPDOs和TILs接种在水凝胶两端来评价TILs的迁移能力和趋化性,结果显示,与单用IL-2或IL-2和CD3抗体联用比较,IL-2+PD-1抗体组TILs的趋化性和迁移能力最强。作者还利用基质胶体系共培养TILs和MPDOs,二者标记不同颜色后发现,IL-2+PD-1组的TILs浸润MPDOs的能力最强。
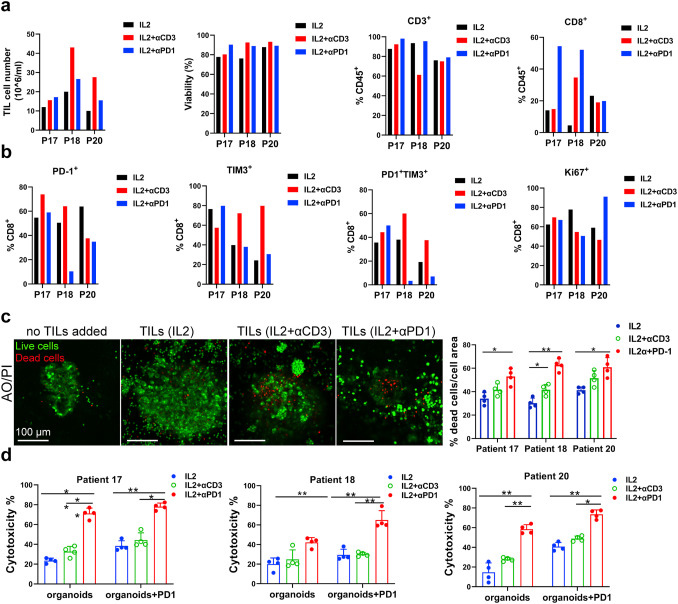
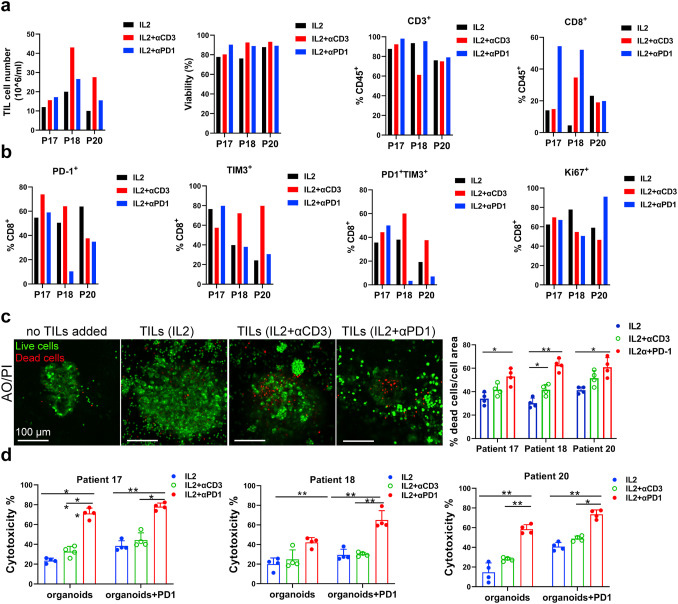
原文图 6 自体TILs应用到免疫疗法中
作者基于基质胶培养的MPDOs来直接评价不同处理组TILs对肿瘤的杀伤能力。死、活细胞染色的实验结果显示,IL-2+PD-1抗体组或者IL-2+CD3抗体组的TILs杀伤能力显著强于单独使用IL-2组。各组乳酸脱氢酶(LDH)的检测结果显示IL-2+PD-1抗体组的TILs细胞毒性比其他两组更强。作者据此得出结论,IL-2和PD-1抗体联用扩增的TILs能更好地浸润MPDOs并发挥更好的杀伤效果。
6、筛选能够增强TILs功能的小分子化合物
原文图 7 利用MPDOs筛选小分子物质
作者通过构建的MPDOs来筛选能增强TILs对MPDOs杀伤作用的小分子物质,经过细胞活力和细胞毒性的检测,作者确认了Bcl-xl抑制剂:Navitoclax具有较好的促进作用,显示了这一模型在小分子物质筛选上的独特优势。
三、 编者点评
作者利用两种方法成功构建黑色素瘤类器官,且利用两种方法的各自特点来评价免疫疗法,指标较为全面。但本文实验设计主线不够突出,行文逻辑稍显混乱,对于相关工作的指导意义有限。
作为斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系。目前,环特类器官平台已建立肿瘤类器官-免疫细胞共培养体系,在近期内将推出免疫疗法治疗抗肿瘤药物的敏感性检测服务,敬请期待!
参考文献
[1] Keung EZ, Gershenwald JE. The eighth edition American Joint Committee on Cancer (AJCC) melanoma staging system: implications for melanoma treatment and care. Expert Rev Anticancer Ther. 2018 Aug;18(8):775-784.
[2] Ascierto PA, Flaherty K, Goff S. Emerging Strategies in Systemic Therapy for the Treatment of Melanoma. Am Soc Clin Oncol Educ Book. 2018 May 23;38:751-758.
[3] Silva IP, Long GV. Systemic therapy in advanced melanoma: integrating targeted therapy and immunotherapy into clinical practice. Curr Opin Oncol. 2017 Nov;29(6):484-492.
[4] Shannan B, Perego M, Somasundaram R, Herlyn M. Heterogeneity in Melanoma. Cancer Treat Res. 2016;167:1-15.
[5] Mak IW, Evaniew N, Ghert M. Lost in translation: animal models and clinical trials in cancer treatment. Am J Transl Res. 2014 Jan 15;6(2):114-8.
[6] Seip K, Jørgensen K, Haselager MV, Albrecht M, Haugen MH, Egeland EV, Lucarelli P, Engebraaten O, Sauter T, Mælandsmo GM, Prasmickaite L. Stroma-induced phenotypic plasticity offers phenotype-specific targeting to improve melanoma treatment. Cancer Lett. 2018 Dec 28;439:1-13.
[7] Klemm F, Joyce JA. Microenvironmental regulation of therapeutic response in cancer. Trends Cell Biol. 2015 Apr;25(4):198-213.
[8] Quail DF, Joyce JA. Microenvironmental regulation of tumor progression and metastasis. Nat Med. 2013 Nov;19(11):1423-37.