业务咨询

![]() 发布时间:2023-12-29
发布时间:2023-12-29
![]() 环特生物
环特生物
![]() 浏览次数:3578
浏览次数:3578

编者按
今天,我们特别关注一项于2021年6月发表在《Nature Communications》的新研究——《Generation of functional liver organoids on combining hepatocytes and cholangiocytes with hepatobiliary connections ex vivo》,该研究提出了一种小鼠肝胆类器官模型,其中包含由小肝细胞(SHs)衍生的肝细胞簇以及由上皮细胞粘附分子阳性(EpCAM+)胆管细胞衍生的胆管网络。通过探索从胆道组织中收集肝细胞代谢物的方法,可以建立一个药物代谢检测系统。含有人类肝细胞的HBTO(例如hCLiP)可用于肝损伤研究和新药开发。该研究结果为体内外生成功能性肝组织提供了一个基本概念和系统。
一、研究背景
上皮器官由多种类型的上皮组织组成,如肝脏中的胆小管(BC)和胆管(BDs)等。连接两类组织的结构是每个器官所特有的,包括空气、尿液、消化酶和胆汁在内的各种物质在流经连接结构时其成分会发生变化。因此,准确连接由不同类型上皮细胞组成的组织结构,对于在体内重现每个器官的功能至关重要。
在三维(3D)环境中培养组织干细胞,能够使细胞生长、分裂和自组织成类似于体内的组织结构[1-5]。类器官的体积可以扩大,其中很可能含有维持组织干细胞和祖细胞的生态位。然而,每个类器官都由单一类型的组织组成,并不包含连接不同类型上皮细胞的结构。
共培养是一种用于生成由多种类型组织组成的类器官技术。在人源诱导多能干细胞(hiPSC)的肝母细胞样细胞、血管内皮细胞和间充质细胞的培养过程中,已经开发出具有血管系统的肝类器官[6]。当类器官移植到免疫缺陷小鼠体内时,类器官中的肝细胞可以通过血流交换代谢物质[7]。然而,此类器官不包含从肝组织排出细胞毒性胆汁所必需的胆管结构。
在本研究中,研究人员提出了一种小鼠肝胆类器官模型,其中包含由小肝细胞(SHs)衍生的肝细胞簇以及由上皮细胞粘附分子阳性(EpCAM+)胆管细胞衍生的胆管网络。SHs是从健康成年小鼠中分离出来的内源性肝细胞祖细胞,其体积较小,随后在体外和体内增殖并分化为功能性肝细胞[8, 9]。
在此肝胆类器官中,胆红素和荧光素标记的胆汁酸被肝细胞吸收,排泄到BCs中,然后在胆道系统中累积,表明肝细胞和胆管细胞之间已经建立了联系。由于肝细胞簇在功能上与胆管相连,研究人员将这种类器官称为“肝胆管状类器官(HBTO)”。HBTO中的肝细胞可获得并维持代谢功能1个月以上,其发展能够研究肝细胞代谢物在肝组织内的转运,并在体外长期监测肝细胞的代谢。通过探索从胆道组织中收集肝细胞代谢物的方法,可以建立一个药物代谢检测系统。含有人类肝细胞的HBTO(例如hCLiP)可用于肝损伤研究和新药开发。该研究结果为体内外生成功能性肝组织提供了一个基本概念和系统。
二、主要研究成果
1、在肝细胞和胆管细胞的共培养物中诱导肝胆连接
研究人员使用从健康成年小鼠体内分离的SHs和原代胆管细胞,采用夹层培养法进行共培养(I型胶原凝胶用作底层,含有20%MG的I型胶原凝胶(Col-MG)用作顶层)。待胆管细胞扩增并在胶原凝胶上形成集落后将SHs添加到培养物中(图1a)。在这些条件下,SHs附着在胆管细胞集落之间的空隙中,并且在铺板一天后可以观察到与胆管细胞的紧密连接(图1b左图)。Col-MG覆盖两周后,肝细胞呈现出与成熟肝细胞(MHs)相似的细胞形态,具有大量细胞质和圆形细胞核,并形成BC网络;同时,胆管细胞形成管状网络。在此阶段,能够在相差显微镜下发现肝细胞和胆管细胞之间的管腔连接(图1b右图)。
Col-MG覆盖后四周进行免疫荧光分析,以检测肝胆连接的光学横截面(图1c)。结果显示,HNF4α+肝细胞簇内形成的BC网络(图1c右上箭头)连接到由CK19+胆管细胞和HNF4α+肝细胞组成的管腔(图1c右中箭头),然后最终连接到由CK19+胆管细胞组成的导管(图1c右下箭头)。使用相差显微镜可以观察胆管细胞和肝细胞之间边界上的肝胆连接,由于肝细胞簇与胆管相连,因此将这种类器官命名为“HBTO”。
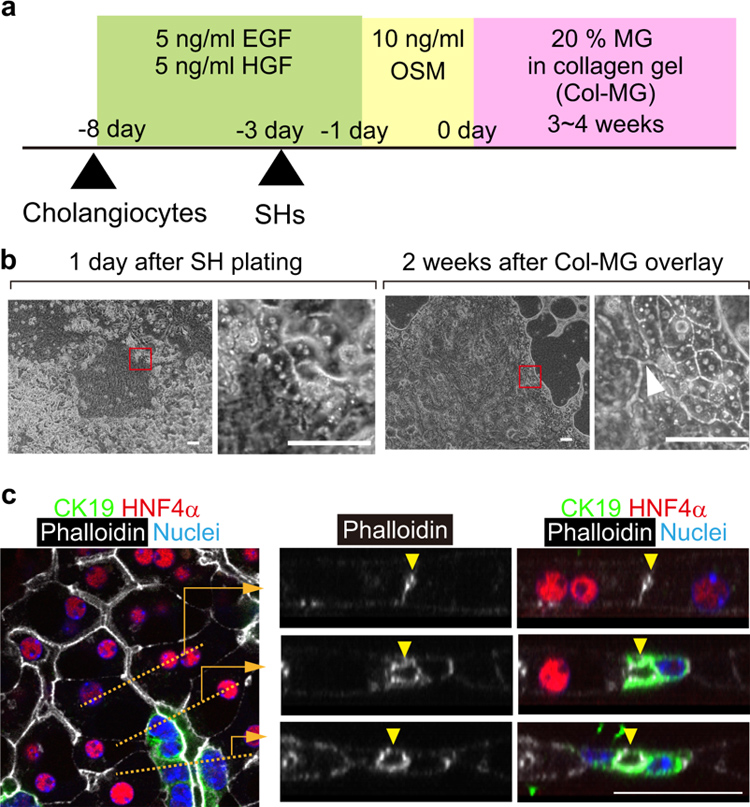
原文图1
2、肝细胞和胆管细胞维持其谱系以建立HBTO
近期研究表明,肝细胞和胆管细胞具有可塑性[10-13]。图1c已表明肝细胞和胆管细胞(而非任何中间细胞)形成了肝胆连接。研究人员进一步对肝细胞或胆管细胞是否表现出中间细胞的特征进行研究,使用CEACAM抗体特异性标记肝细胞顶端膜,使用EZN抗体标记胆管细胞。如图2a上图所示,CEACAM+EZN-肝细胞(实心箭头)和CEACAM-EZN+胆管细胞(空心箭头)形成连接处,在HBTO中并没有发现CEACAM+EZN+细胞。随后对胆管细胞标记物CK19、SOX9和OPN的表达以及肝细胞标记物RDX的表达进行研究(图2a中图和下图),肝细胞(实心箭头)和胆管细胞(空心箭头)的顶端膜包围着肝胆交界处的管腔空间。同样并没有发现同时表达肝细胞和胆管细胞标记物的细胞。
在肝胆连接的生成过程中,肝细胞仍有可能完全转化为胆管细胞,反之亦然。为了研究谱系转化是否参与肝胆形态发生,研究人员将从CAG-Cre:ROSA-tdTomato小鼠中分离出的SHs与野生型EpCAM+胆管细胞培养(图2b)。tdTomato+CK19-肝细胞(图2b最右上图)的BC与tdTomato-CK19+胆管组织的管腔相连(图2b最右下图)。在边界处,tdTomato+CK19-肝细胞和tdTomato-CK19+胆管细胞包围管腔结构(图2b最右中间图)。结果表明并没有检测到tdTomato+胆管细胞或tdTomato-肝细胞。总体来说,肝细胞和胆管细胞在HBTO中保持了其原始谱系并形成了肝胆连接。
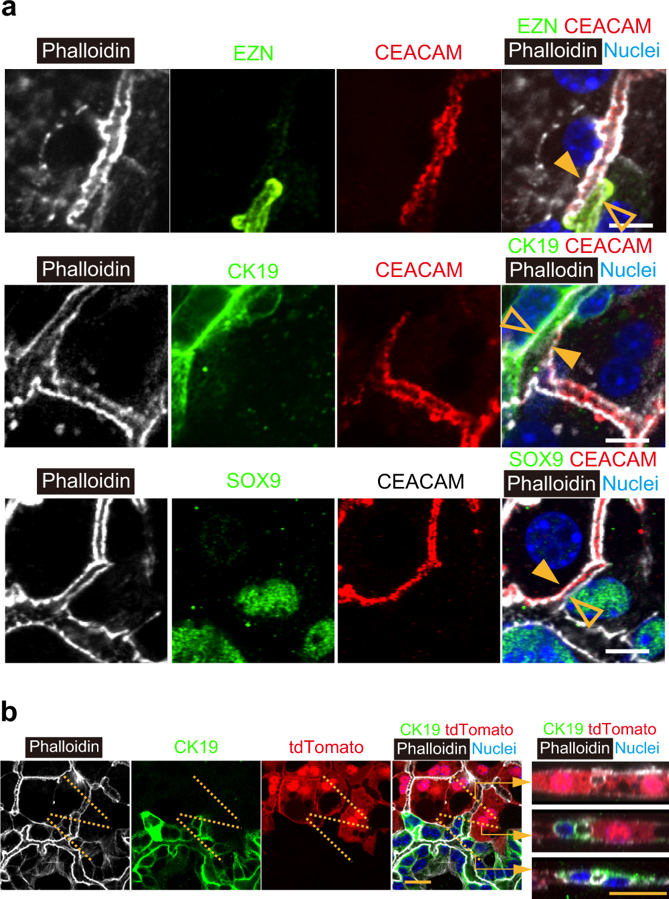
原文图2
3、HBTO中肝细胞代谢物的转运
功能性肝细胞内会发生多种代谢反应。这些反应产生的代谢物被分泌到BC中,然后被转运到肝内胆管(IHBD)中。为了证明肝细胞和胆管细胞在HBTO中的功能联系,研究人员对肝细胞产生的代谢物是否分泌到BC中并最终转运到由胆管细胞组成的管状结构中进行研究:将5-氯甲基荧光素二乙酸酯(CMFDA)加入HBTO,并检测该化合物是否在胆管组织中积累(当肝细胞和胆管细胞建立功能连接时,荧光素会在胆管组织中积累)。
HBTO在含有CMFDA的培养基中培养10分钟后,在BC网络中检测到高浓度的荧光素,培养120分钟后发现更多的荧光素被转运至胆管组织(图3a)。然后,研究人员将荧光素标记的胆汁酸-胆酰赖氨酸荧光素(CLF)添加到HBTO中,并跟踪其转运情况。约30分钟,CLF通过胆盐输出泵分泌到BC,并在6小时后在胆道组织中积累(图3b),表明分泌至BC的CLF被转运至胆道网络。
最后,将HBTO暴露于胆红素,研究胆红素是否被代谢并在胆道网络中积累。培养五天后,通过将胆红素氧化为胆绿素来进行分析。图3c显示在胆道和胆管网络中均检测到胆绿素,表明肝细胞吸收并修饰胆红素,然后将胆红素排泄至胆管并转运至胆管网络。这些结果表明HBTO重现了肝细胞代谢产物在体内肝组织中的转运。
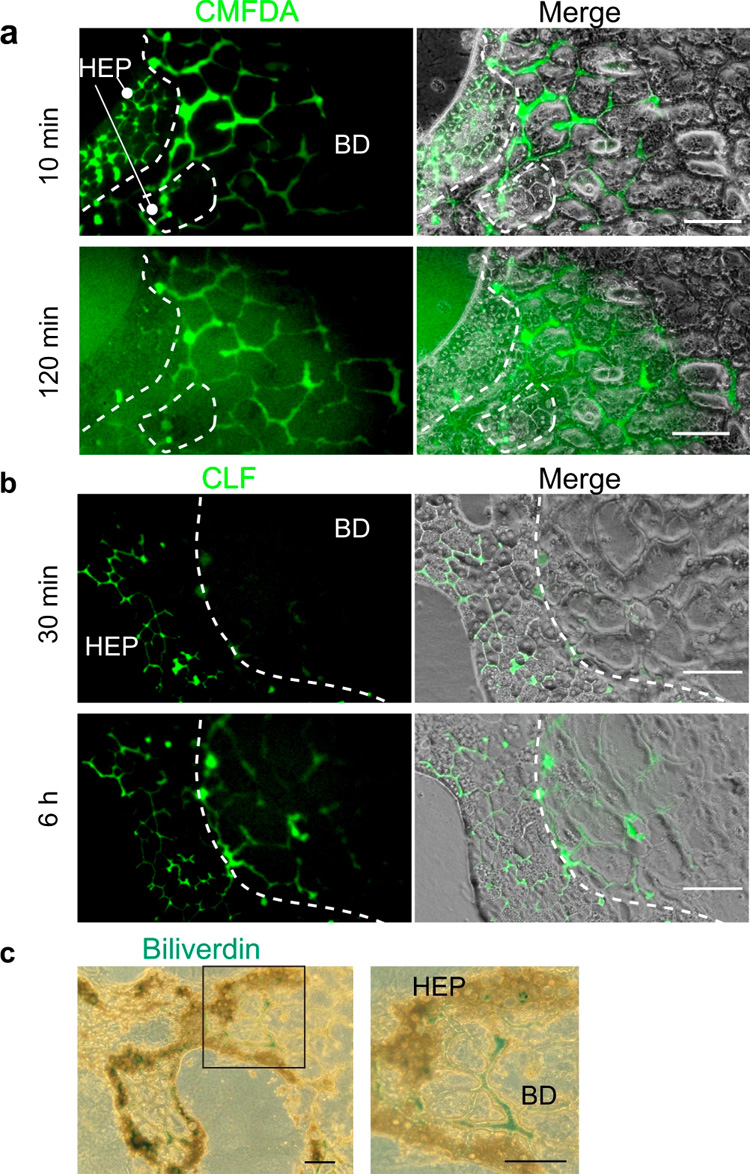
原文图3
4、肝细胞在HBTOs中维持代谢功能
为了提供药物代谢的检测系统,在HBTOs中诱导分化良好的肝细胞的细胞特征非常重要。HBTO中的肝细胞分泌的白蛋白(ALB)是SH衍生肝细胞(Hep)的三倍(图4a)。与Hep相比,HBTOs显示出更高的CYP1A1样和CYP3A4样活性(图4b)。HBTOs分泌的ALB逐渐增加,高水平的ALB分泌能够持续一个多月(图4c)。HBTOs中的肝细胞也吸收DiI-AcLDL(乙酰化低密度脂蛋),这进一步表明它们具有功能性(图4d)。HBTOs的生成促进了肝功能并有助于长期维持这些功能。
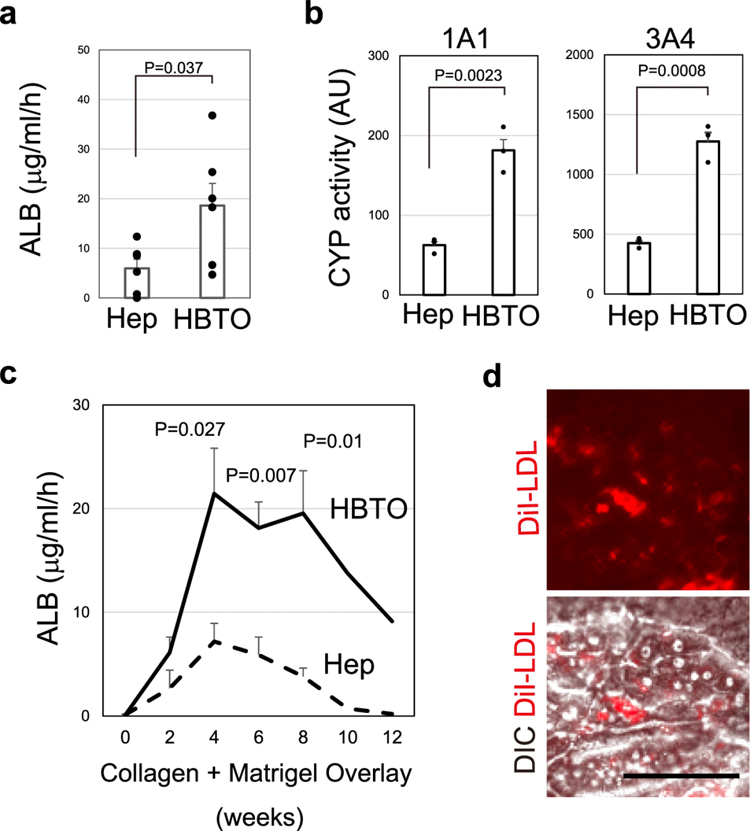
原文图4
5、SHs是门静脉周围肝细胞和小叶中央区肝细胞的亚组分
研究人员利用胆管细胞和SHs建立了HBTOs并测试了MHs作为HBTOs的肝细胞来源,但它们与胆管细胞形成连接的效率不如SHs(图5a)。
膜蛋白有助于区分不同的细胞群。在肝脏中,E-cadherin(ECAD)在ZONE1和ZONE2肝细胞中表达,claudin-2(CLDN2)在ZONE3肝细胞中表达(图5b)。RNA序列数据表明SHs位于ZONE1和ZONE2,SHs比MHs表达更多的Ecad/Cdh1和更少的Cldn2(图5c)。FACS分析进一步证明SHs对ECAD呈强阳性,而MHs同时含有ECAD+和ECAD-细胞(图5d)。与ECAD-MHs相比,ECAD+MHs与胆管细胞生成肝胆连接的效率更高(图5e)。这些结果表明,ZONE1和ZONE2中的MHs以及SHs都具有强ECAD表达的细胞特征,它们可以参与肝胆与胆管细胞的连接。
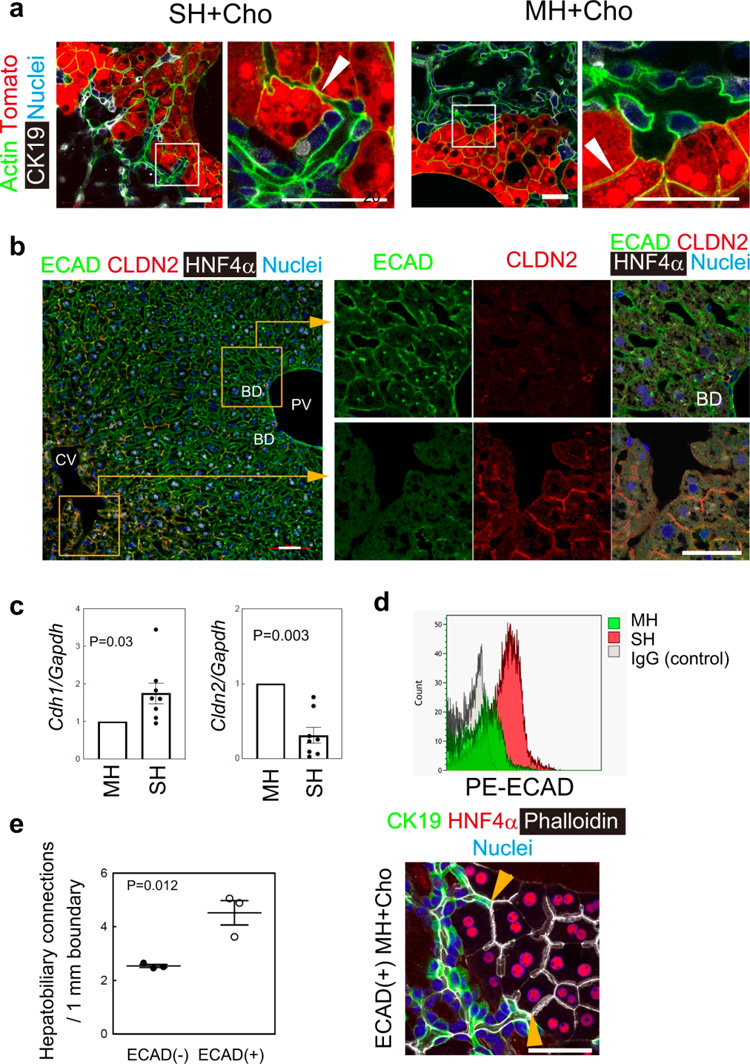
原文图5
6、生成含有人类肝细胞的混合HBTOs
在制药和临床应用中,必须将人肝细胞引入肝脏类器官中。为此,研究人员将人类重编程肝细胞(hCLiP)与小鼠胆管细胞进行共培养,它可以在体外稳定分化形成功能性肝细胞[21]。单独培养hCLiP时,它们会分化为形态上类似于MHs的肝细胞,但不形成BC样结构(图6a左侧两图)。
在与tdTomato+小鼠胆管细胞共培养时,BC样结构明显可见(图6a右侧两图)。免疫荧光分析表明,BC样结构(图6b右上图)通过由肝细胞和胆管细胞组成的管腔(右中图)与胆管结构(右下图)连接。当将CLF添加到培养基中时,CLF在由tdTomato+胆管细胞组成的管腔空间中积累(图6c),表明人肝细胞和小鼠胆管细胞可以建立功能连接。
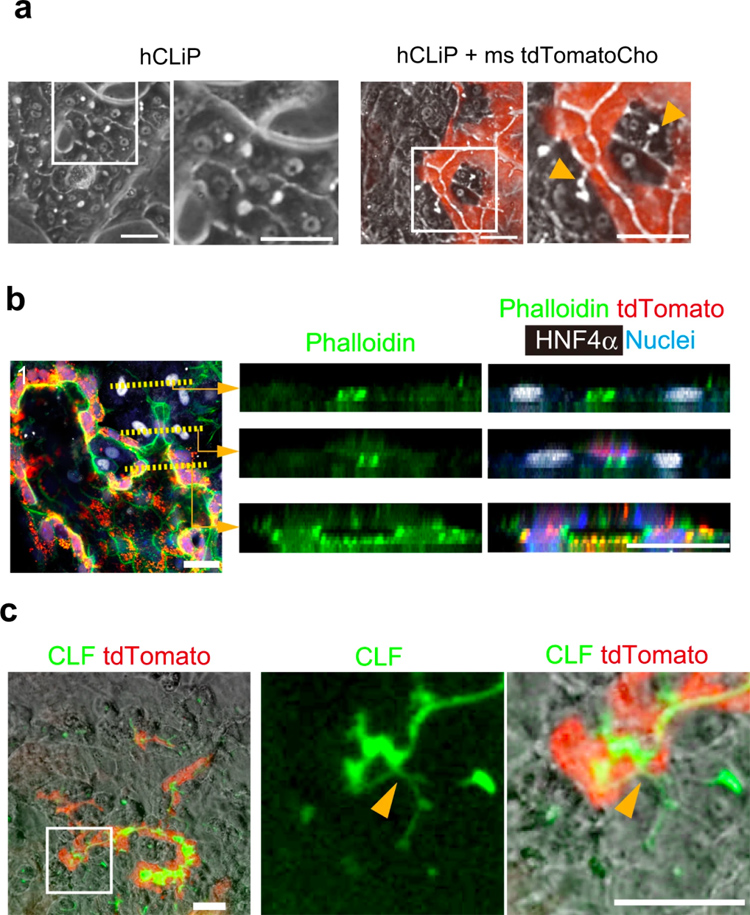
原文图6
三、编者点评
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特类器官平台已成功搭建多种肿瘤及正常类器官的培养平台,欢迎有需要的读者垂询!
参考文献
[1] Sato, T. et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature 459, 262 (2009).
[2]. Noguchi, T. K. et al. Generation of stomach tissue from mouse embryonic stem cells. Nat. Cell Biol. 17, 984 (2015).
[3]. Yui, S. et al. Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5(+) stem cell. Nat. Med. 18, 618 (2012).
[4]. Hu, H. et al. Long-term expansion of functional mouse and human hepatocytes as 3d organoids. Cell 175, 1591 (2018).
[5]. Peng, W. C. et al. Inflammatory Cytokine TNF alpha promotes the long-term expansion of primary hepatocytes in 3D culture. Cell 175, 1607 (2018).
[6]. Takebe, T. et al. Massive and reproducible production of liver buds entirely from human pluripotent stem cells. Cell Rep. 21, 2661 (2017).
[7]. Takebe, T. et al. Vascularized and functional human liver from an iPSCderived organ bud transplant. Nature 499, 481 (2013).
[8]. Mitaka, T. et al. Reconstruction of hepatic organoid by rat small hepatocytes and hepatic nonparenchymal cells. Hepatology 29, 111 (1999).
[9]. Tanimizu, N. et al. Liver progenitors isolated from adult healthy mouse liver efficiently differentiate to functional hepatocytes in vitro and repopulate liver tissue. Stem Cells 34, 2889 (2016).
[10]. Yanger, K. et al. Robust cellular reprogramming occurs spontaneously during liver regeneration. Genes Dev. 27, 719 (2013).
[11]. Tanimizu, N. et al. Sry HMG box protein 9-positive (Sox9+) epithelial cell adhesion molecule-negative (EpCAM-) biphenotypic cells derived from hepatocytes are involved in mouse liver regeneration. J. Biol. Chem. 289, 7589 (2014).
[12]. Tarlow, B. D. et al. Bipotential adult liver progenitors are derived from chronically injured mature hepatocytes. Cell Stem Cell 15, 605 (2014).
[13]. Raven, A. et al. Cholangiocytes act as facultative liver stem cells during impaired hepatocyte regeneration. Nature 547, 350 (2017).