业务咨询

皮脂腺是雄激素的来源和目标组织,皮脂腺中产生脱氢表雄酮,经过一系列的酶催化转化为最活跃的睾酮和5α-双氢睾酮,他们能够刺激脂质的合成以及皮脂腺细胞的增殖分化。尼罗红(Nile Red)是一种亲脂性的荧光染料,能够与细胞内的中性脂质(如甘油三酯)结合并发出荧光。其荧光强度与细胞内的脂质含量成正比,因此可以通过荧光显微镜观察检测细胞内的脂质含量。
皮脂腺细胞的脂质合成需要细胞内相关脂质基因表达的激活。固醇调节元件结合蛋白(sterol regulatory element binding protein, SREBP)介导的脂质代谢通路是研究脂质代谢调控机制的首要环节,其中SREBP是脂质代谢通路中的关键调控因子,调控外源脂质的摄入和内部脂质合成等过程。SREBP-1C属于SREBP家族,是脂质代谢信号转导的关键调节因子。脂滴包被蛋白(PLIN)家族成员之一的PLIN2,也称为脂肪分化相关蛋白,参与脂质代谢并影响脂肪沉积。在皮脂腺细胞中,PLIN2可能通过影响脂质的合成与分解代谢,进而对皮脂分泌产生调控作用。PPARγ(过氧化物酶体增殖激活受体γ)在皮肤生理学中扮演着重要角色,尤其是在皮脂分泌和炎症反应的调控中。PPARγ通过靶向LPL(脂蛋白脂酶)、ANGTPL4(血管生成素相关蛋白4)和CIDEC(细胞死亡诱导因子C)等基因,促进脂肪细胞的自我更新。PPARγ和C/EBPα通过正反馈形式的相互调控促进下游脂肪分化相关蛋白的表达水平,也包括脂肪合成相关基因的转录。此外,PPARγ激活可以提升脂肪细胞和肝细胞中周脂素(PLIN)基因的表达水平,这对于脂滴(LD)的形成至关重要。周脂素的表达量可以决定脂滴的丰富性。有研究证明,激活PPARγ可以促进PLIN1、PLIN2和PLIN3 mRNA的表达,同时上调甘油-3磷酸酰基转移酶(Gpat)和二酰基甘油酰基转移酶(Dgat)的表达水平,进而促进甘油三酯(TAG)合成与脂滴(LD)形成。脂肪酸合成酶(FAS)是脂肪酸合成的关键酶,负责将乙酰辅酶A(Acetyl-CoA)和丙二酰辅酶A(Malonyl-CoA)合成脂肪酸。ACACA(乙酰辅酶A羧化酶A,ACC)是脂肪酸合成途径中的一个关键酶,它催化脂肪酸生物合成的第一步反应,即乙酰辅酶A转化为丙二酸单酰辅酶A。硬脂酰辅酶A去饱和酶(SCD)负责将饱和脂肪酸转化为单不饱和脂肪酸,是脂肪酸去饱和的关键酶。
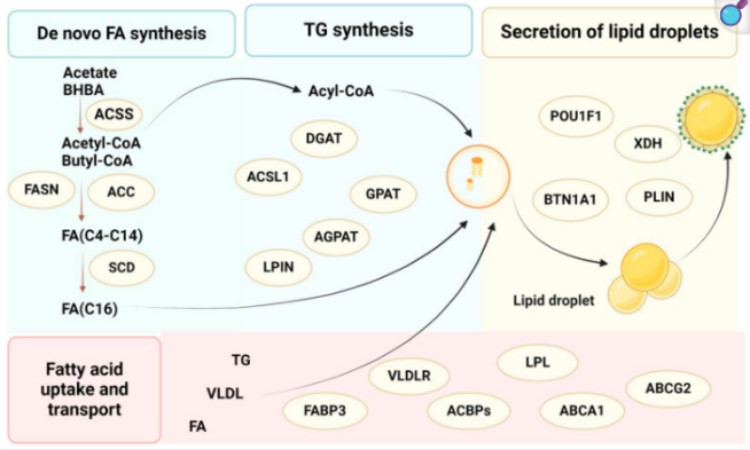 图1.参与脂质合成的关键基因
图1.参与脂质合成的关键基因
脂质合成是皮脂腺细胞分化的终末指标,瘦素、胰岛素样生长因子-1(IGF-1)、胰岛素和TNF-α等细胞因子参与调节其脂质合成,成为寻常痤疮发生的重要致病因子。胰岛素样生长因子1受体(IGF-1R)是一种在细胞增殖、分化、转化中发挥作用的跨膜受体。它与皮脂腺细胞分泌油脂的作用相关,它可以影响细胞的增殖和分化,这些过程也与皮脂腺细胞的功能相关。IGF-1R的激活可以通过特定的信号传导路径,如MAPK和PI3K/AKT,促进细胞增殖和生长,这可能间接增加皮脂细胞的油脂产生。此外,IGF-1R信号通路在一些皮肤病的发展中也起作用,例如痤疮和银屑病,这些疾病与皮脂腺的过度活跃有关。在这些情况下,IGF-1R的激活可能导致皮脂腺细胞的过度增殖和油脂产生,从而加剧皮肤病症状。
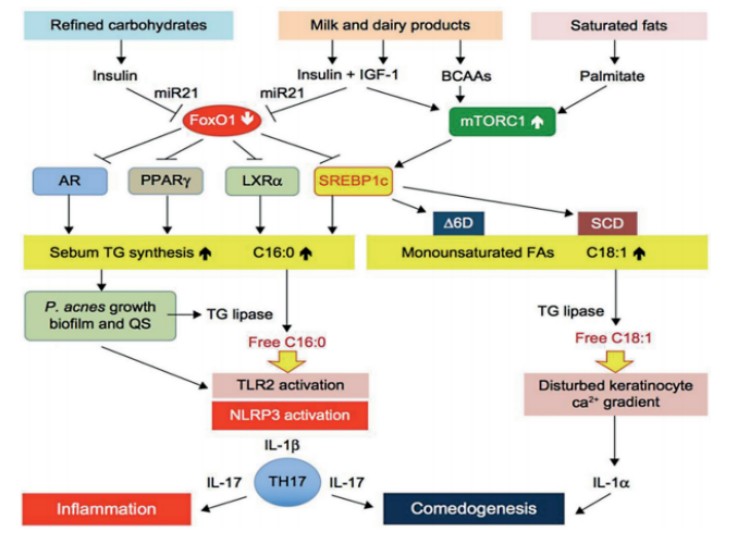 图2.IGF-1影响痤疮发生的分子机制
图2.IGF-1影响痤疮发生的分子机制
在皮肤中,5α还原酶是皮肤油脂分泌的一个关键限速酶,主要负责将睾酮转化为双氢睾酮(DHT),后者是一种更强力的雄激素,具体传导路径如图3所示。双氢睾酮(DHT)在皮脂腺内积累到较高水平时,它会引发皮脂腺细胞的一系列病理变化。这种变化会促使皮脂腺细胞过度活跃,导致它们分泌出过多的油脂。因此,通过降低或抑制5α还原酶的活性或表达量,可以有效地减少皮脂腺的油脂分泌量。换句话说,调控5α还原酶是控制皮脂过度分泌的一种策略,有助于缓解与皮脂分泌过多相关的问题。
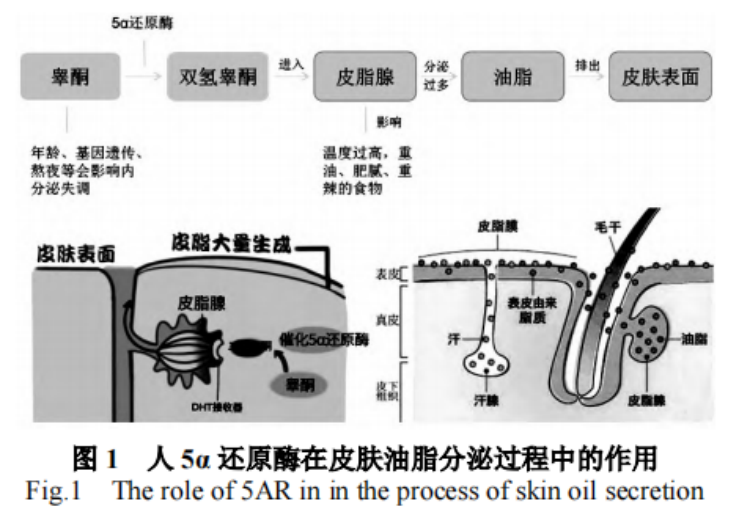 图3.人5α-还原酶在皮肤油脂分泌过程中的作用
图3.人5α-还原酶在皮肤油脂分泌过程中的作用
因此,本实验拟通过利用DHT诱导人皮脂腺细胞活化模型,通过尼罗红染色法检测人皮脂腺细胞脂质的积累,通过RT-QPCR检测人皮脂腺细胞内脂质代谢相关基因表达量(PPARγ、SREBP-1C、IGF-1R、PLIN2、FAS、SCD和ACC),通过理化方法检测5α-还原酶抑制率,多维度评价样品样品是否具有控油功效。
尼罗红染色检测细胞脂质积累
RT-QPCR检测脂质代谢相关基因(PPARγ, SREBP-1C, IGF-1R, PLIN2, FAS, SCD, ACC)表达量
5α-还原酶抑制率检测
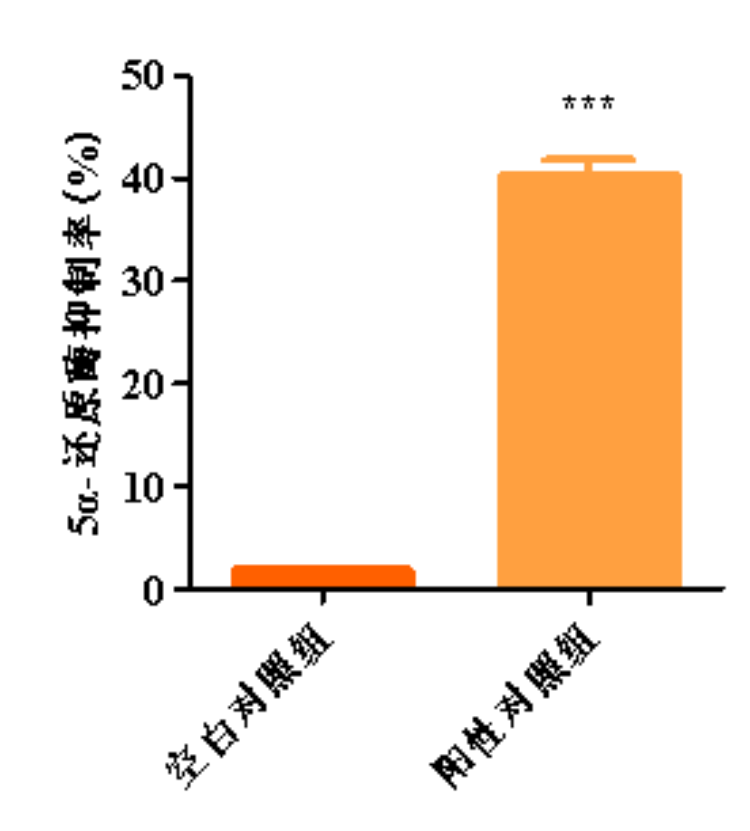
图1.5α-还原酶抑制率柱形图
与空白对照组比,***p<0.001
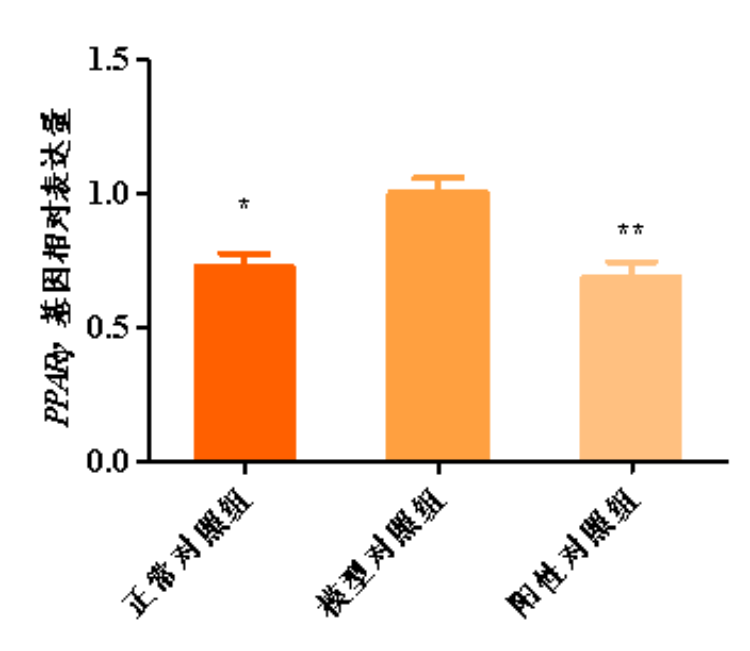
图2.PPARγ基因相对表达量柱形图
与模型对照组比,*p<0.05,**p<0.01
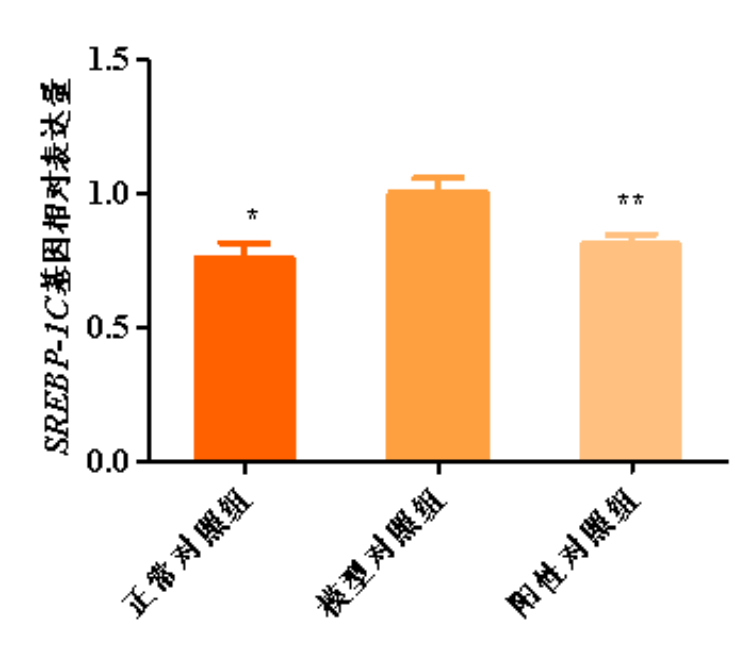
图3.SREBP-1C基因相对表达量柱形图
与模型对照组比,*p<0.05,**p<0.01
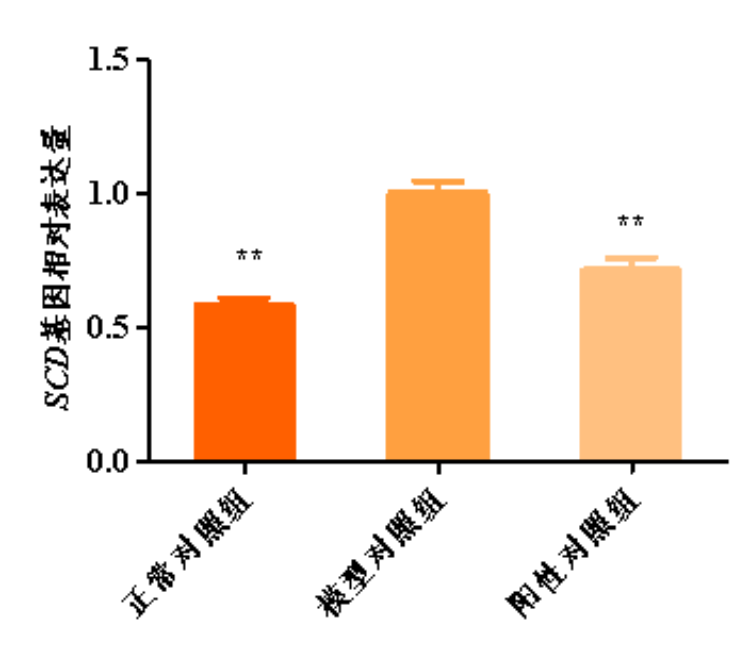
图4.SCD基因相对表达量柱形图
与模型对照组比,**p<0.01
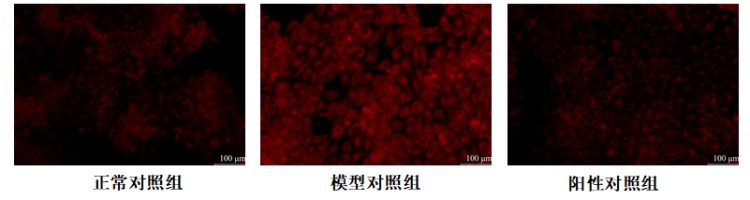
图5.平均荧光强度典型图
根据测试结果,与正常对照组比,模型对照组的平均荧光强度显著增强,PPARγ,SREBP-1C,SCD等基因相对表达量显著上调,说明本次刺激条件有效;
与模型对照组比,阳性对照组的平均荧光强度显著减弱,PPARγ,SREBP-1C,SCD等基因相对表达量显著下调,说明本实验有效且可靠。
与空白对照组比,阳性对照组的5α-还原酶抑制率显著上升,本实验有效且可靠。
何陵玲, 张毅, 龚秋君, 等. 痤疮的机理症状及祛痘型护肤品功效类型[J]. 日用化学工业, 2020, 50(05): 336-342.
刘武阳. 黄连活性成分分离及抑制人皮脂腺细胞雄性激素合成机制研究[D]. 西南大学, 2020.
李远宾. 雄激素诱导毛囊干细胞向皮脂腺细胞分化的初步研究[D]. 第三军医大学, 2008.
朱迎全, 朱聪聪, 董怡彤, 等. 祛痘方提取物抗炎祛痘体外功效评价[J]. 上海医药, 2024, 45(11): 7-11+22.
朴光春, 王瑜, 吕旭阳, 等. D-四氢掌叶防己碱通过AMPK信号通路抑制HepG2肝癌细胞脂肪蓄积的作用及其机制[J].延边大学医学学报, 2013(3): 174-177.
汤红燕, 肖斌, 刘鑫, 等. 寻常痤疮发病机制相关信号通路的研究进展[J]. 中国医学科学院学报, 2020, 42(04): 559-561.
崔心禹, 夏琛, 金蒙, 等. 油茶叶提取物的5α-还原酶抑制活性及化学成分分析[J]. 食品工业科技, 2021, 42(19): 97-105.
梁. 蜂花粉抑制5α-还原酶活性物质的研究[D]. 浙江工业大学, 2012.
Barrault C, Garnier J, Pedretti N, Cordier-Dirikoc S, Ratineau E, Deguercy A, Bernard FX. Androgens induce sebaceous differentiation in sebocyte cells expressing a stable functional androgen receptor. J Steroid Biochem Mol Biol. 2015 Aug;152:34-44.
Yu Y, Fu R, Jin C, Gao H, Han L, Fu B, Qi M, Li Q, Suo Z, Leng J. Regulation of Milk Fat Synthesis: Key Genes and Microbial Functions. Microorganisms. 2024 Nov 13;12(11):2302.
Makrantonaki E, Ganceviciene R, Zouboulis C. An update on the role of the sebaceous gland in the pathogenesis of acne. Dermatoendocrinol. 2011 Jan;3(1):41-9.
金超颖, 吴慧玲. PPARs在皮肤生理学中的意义[J]. 临床医学进展, 2024, 14(3): 1396-1404.
叶枫, 莫小辉, 胡婷婷, 李昕, 魏子妤, 李嘉祺, 陈广洁, Christos C. Zouboulis, 鞠强. Clascoterone对SZ95人皮脂腺细胞增殖、脂质合成和炎症因子表达的影响[J]. 中国麻风皮肤病杂志, 2022, 38(6): 349-354.
Kurokawa I and Nakase K. Recent advances in understanding and managing acne [version 1; peer review: 2 approved]. F1000Research 2020, 9(Faculty Rev):792
严正声明:以上内容所涉及的核心知识产权归杭州环特生物科技股份有限公司所有。任意第三方机构或个人在未经授权的前提下抄袭、剽窃、恶意传播均属侵害我司正当权益的行为,我司不排除诉诸一切法律手段维护自身合法权益。